题目内容
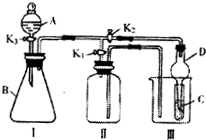
如图是实验室中制备气体或验证气体性质的装置图
(1)仪器安装好后必须进行的操作是______.
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+、
Cl2>I2,则①装置B中的溶液的作用是______.
②装置中加的最佳试剂是(填序号)C中______、D中______;
供选试剂:a.Na2SO3溶液b.FeCl2溶液c.KSCN与FeCl2的混合溶液 d.KI溶液e.湿润的淀粉KI试纸
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和还原性实验2:证明碳元素的非金属性比硅元素的强
①证明SO2具氧化性和还原性:B中为少量Na2S溶液,现象为______;C中为少量酸性KMnO4溶液,发生反应的离子方程式为______+______H2O→______(不用配平).
②D中应加入足量的______(填溶液名称),E中加入______溶液(填化学式),证明碳元素的非金属性比硅元素的强的现象为______.
③实验2不严谨之处应如何改进______.

(1)仪器安装好后必须进行的操作是______.
(2)利用上图装置制备纯净的氯气,并证明氧化性:Cl2>Fe3+、
Cl2>I2,则①装置B中的溶液的作用是______.
②装置中加的最佳试剂是(填序号)C中______、D中______;
供选试剂:a.Na2SO3溶液b.FeCl2溶液c.KSCN与FeCl2的混合溶液 d.KI溶液e.湿润的淀粉KI试纸
(3)在上图所示圆底烧瓶内加入碳,a中加入浓硫酸,开始实验,加热产生的气体缓慢通过后续装置同时完成如下实验:
实验1:证明SO2具有氧化性和还原性实验2:证明碳元素的非金属性比硅元素的强
①证明SO2具氧化性和还原性:B中为少量Na2S溶液,现象为______;C中为少量酸性KMnO4溶液,发生反应的离子方程式为______+______H2O→______(不用配平).
②D中应加入足量的______(填溶液名称),E中加入______溶液(填化学式),证明碳元素的非金属性比硅元素的强的现象为______.
③实验2不严谨之处应如何改进______.

(1)安装好仪器后先检查气密性,气密性好才能进行实验,
故答案为:检验装置的气密性;
(2)①氯气中含有氯化氢气体,通过装置B饱和食盐水可以吸收氯化氢,
故答案为:饱和食盐水;
②本实验目的之一为证明氧化性:Cl2>Fe3+、
Cl2>I2,因此选含亚铁离子的物质被氯气氧化成铁离子使硫氰化钾变红色来来证明Cl2>Fe3+、
用含碘离子的物质被氯气氧化成单质碘,根据碘遇淀粉变蓝实验现象来证明,
故答案为:c;e;
(3)①证明SO2具有氧化性的装置是B,装置中析出黄色沉淀,说明二氧化硫把硫离子氧化成单质硫;
高锰酸钾具有强氧化性,能把二氧化硫氧化成硫酸,本身被还原为锰离子,反应的方程式为:MnO4-+SO2+H2O→Mn2-+SO42-+H+;
故答案为:B中析出黄色沉淀;MnO4-+SO2+H2O→Mn2-+SO42-+H+;
②元素的非金属性越强,最高价氧化物对应的水化物酸性越强,利用碳酸的酸性强于硅酸,
二氧化碳能与硅酸钠反应制得硅酸沉淀,由于CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,
需要酸性高锰酸钾溶液除去并再次通过酸性高锰酸钾溶液是否除尽,D装置是检验二氧化硫是否除净,防止干扰检验二氧化碳;
故答案为:酸性高锰酸钾溶液,Na2SiO3,D中高锰酸钾溶液不褪色,E中溶液变浑浊;
③空气中含有二氧化碳,可能干扰实验,故应排除空气中二氧化碳的干扰,将烧杯换成洗气瓶,
右端连接盛有碱石灰的干燥管可排除空气中二氧化碳的干扰,
故答案为:将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管.
故答案为:检验装置的气密性;
(2)①氯气中含有氯化氢气体,通过装置B饱和食盐水可以吸收氯化氢,
故答案为:饱和食盐水;
②本实验目的之一为证明氧化性:Cl2>Fe3+、
Cl2>I2,因此选含亚铁离子的物质被氯气氧化成铁离子使硫氰化钾变红色来来证明Cl2>Fe3+、
用含碘离子的物质被氯气氧化成单质碘,根据碘遇淀粉变蓝实验现象来证明,
故答案为:c;e;
(3)①证明SO2具有氧化性的装置是B,装置中析出黄色沉淀,说明二氧化硫把硫离子氧化成单质硫;
高锰酸钾具有强氧化性,能把二氧化硫氧化成硫酸,本身被还原为锰离子,反应的方程式为:MnO4-+SO2+H2O→Mn2-+SO42-+H+;
故答案为:B中析出黄色沉淀;MnO4-+SO2+H2O→Mn2-+SO42-+H+;
②元素的非金属性越强,最高价氧化物对应的水化物酸性越强,利用碳酸的酸性强于硅酸,
二氧化碳能与硅酸钠反应制得硅酸沉淀,由于CO2中混有二氧化硫,二氧化硫也能与硅酸钠溶液反应,
需要酸性高锰酸钾溶液除去并再次通过酸性高锰酸钾溶液是否除尽,D装置是检验二氧化硫是否除净,防止干扰检验二氧化碳;
故答案为:酸性高锰酸钾溶液,Na2SiO3,D中高锰酸钾溶液不褪色,E中溶液变浑浊;
③空气中含有二氧化碳,可能干扰实验,故应排除空气中二氧化碳的干扰,将烧杯换成洗气瓶,
右端连接盛有碱石灰的干燥管可排除空气中二氧化碳的干扰,
故答案为:将烧杯换成洗气瓶,右端连接盛有碱石灰的干燥管.

练习册系列答案
相关题目