题目内容
【题目】工业上利用CO2和H2催化氢化可以制取甲烷。
(1)已知 ①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH= -890 kJ·mol-1
②2H2(g)+O2(g)=2H2O(l) ΔH= -572 kJ·mol-1
③H2O(l)=H2O(g) ΔH= +44 kJ·mol-1
CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH=a kJ·mol-1
CH4(g)+2H2O(g) ΔH=a kJ·mol-1
据此,a=_________;升高温度,该反应的v(逆)_____(填“增大”或“减小”)。
(2)在一定压强、不同温度下,两种催化剂分别催化CO2加氢甲烷化反应2h的结果如图1所示(一定温度下仅改变催化剂,其他条件不变):a、b-催化剂I; c、d-催化剂II。甲烷化选择性:指含碳产物中甲烷的物质的量分数。请据图1分析:
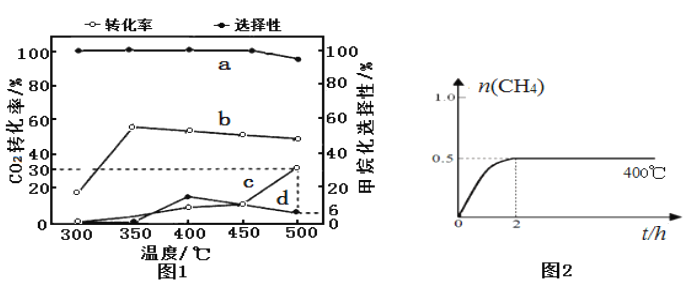
①催化剂I实验,400 ℃~450℃时CO2转化率下降的原因可能为___________(写1条)。
②催化剂II实验,检测密闭容器中产物发现,温度升高甲烷的选择性下降是发生了:CO2(g)+ H2(g)![]() CO(g)+H2O(g) ΔH>0。若保持温度不变,提高甲烷化选择性可以采取的措施:______________(写2条)。
CO(g)+H2O(g) ΔH>0。若保持温度不变,提高甲烷化选择性可以采取的措施:______________(写2条)。
(3)下列与甲烷化反应有关的描述中,正确的是______:
A.单位时间内断裂1molC=O键的同时断裂1molC-H,说明该反应已达平衡
B.照上述反应使用催化剂,其Ⅰ的活化能比Ⅱ的活化能大
C.在绝热的密闭容器中进行时,当容器中温度不变时说明达到平衡
D.催化剂Ⅰ下,300-450℃内,选择性保持不变的主要原因是其它副反应的速率很慢
(4)催化剂I实验, 400℃时,向2L固定体积的密闭容器中通入1mol CO2和4mol H2,CH4物质的量随时间的变化趋势如图2时所示,则2h内H2平均反应速率为____________;平衡常数K=____________。若其他条件不变,反应在恒压条件下进行,请在图2中画出反应体系中n(CH4)随时间t变化的趋势图____________________。
【答案】 -166 增大 可能是温度超过了催化剂最佳活化温度,催化剂活性下降反应速率减小,使 CO2减少转化率下降 [ 或:在2h时已达平衡,继续升温使放热反应平衡逆移,导致CO2转化率下降 改用催化剂I,增加压强;或同倍数增加CO2、H2浓度,控制温度在400℃左右 之间 CD 0.5mol·L-1·h-1 0.25L2· mol-2 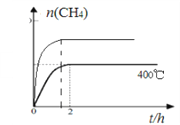
【解析】(1)根据盖斯定律,②×2-①+③×2得:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH=[-572×2-(-890)+44×2]kJ·mol-1=-166 kJ·mol-1,所以a=-166;升高温度,正、逆化学反应速率都加快,故升高温度,该反应的v(逆)增大。
CH4(g)+2H2O(g) ΔH=[-572×2-(-890)+44×2]kJ·mol-1=-166 kJ·mol-1,所以a=-166;升高温度,正、逆化学反应速率都加快,故升高温度,该反应的v(逆)增大。
(2)①催化剂只有在合适的温度时才表现最好的催化活性,可能是温度超过了催化剂最佳活化温度,催化剂活性下降反应速率减小,使2h内CO2减少转化率下降;该反应为放热反应,升高温度不利于提高CO2转化率,若2h时反应已达平衡,继续升温使平衡逆向移动,会导致CO2转化率下降。②由图可得,使用催化剂I甲烷化选择性高,若使用催化剂II,400℃左右甲烷化选择性高;由CO2加氢甲烷化反应方程式可得,增大压强有利于提高甲烷化选择性,所以若保持温度不变,提高甲烷化选择性可以采取的措施有:改用催化剂I、增加压强(或同倍数增加CO2、H2浓度)、控制温度在400℃左右等。
(3)A项,由甲烷化反应方程式可得,断裂1molC=O键同时会生成2molC-H,则断裂1molC=O键的同时断裂1molC-H,说明该反应并没有达到平衡,故A错误;B项,2h内催化剂Ⅰ的催化效果比催化剂Ⅱ的效果好,因为催化剂降低反应的活化能,所以Ⅰ作用下的活化能比催化剂Ⅱ的小,故B错误;C项,甲烷化反应在绝热的密闭容器中进行时,温度为变量,所以当温度不变时说明反应达到平衡,故C正确;D项,催化剂加快化学反应速率,在催化剂Ⅰ作用下,300-450℃内,甲烷化反应速率很快,其它副反应的速率很慢,才会使选择性保持不变,故D正确。综上,选CD。
(4)2h甲烷变化0.5mol,则H2变化2mol,故v(H2)=2mol÷2L÷2h=0.5mol·L-1·h-1;根据相关数据列三段式:

平衡常数K=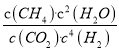 =
=![]() L2mol-2=0.25L2mol-2;若其他条件不变,反应在恒压条件下进行,则与恒容相比相当于不断压缩体积,因此反应速率快且反应程度大,在图2中画出反应体系中n(CH4)随时间t变化的趋势图为:
L2mol-2=0.25L2mol-2;若其他条件不变,反应在恒压条件下进行,则与恒容相比相当于不断压缩体积,因此反应速率快且反应程度大,在图2中画出反应体系中n(CH4)随时间t变化的趋势图为: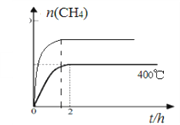 。
。