题目内容
【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O42H2O). 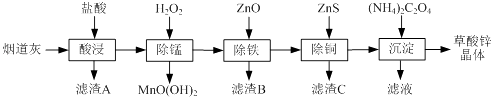
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣A的主要成分为 .
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为 .
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为 . ②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是 .
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是 .
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如下图所示,300℃~460℃范围内,发生反应的化学方程式为 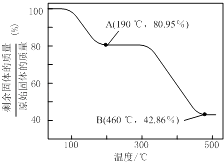
【答案】
(1)SiO2
(2)Mn2++H2O2+H2O=MnO(OH)2↓+2H+
(3)3.3~5.4;先加入ZnS会将Fe3+还原为Fe2+ , 使铁元素难以除去
(4)在搅拌下,将Na2C2O4缓慢加入到ZnCl2溶液中
(5)ZnC2O4 ![]() ZnO+CO↑+CO2↑
ZnO+CO↑+CO2↑
【解析】解:用盐酸酸浸时SiO2不溶解,过滤分离,滤渣A为SiO2 , 滤液中加入过氧化氢进行除锰,再通过调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,过滤分离,滤液中再加入ZnS,Cu2+转化为CuS沉淀,过滤除去,滤液中注意为氯化锌,加入草酸铵得到草酸锌晶体,最终的滤液中含有氯化铵等.(1)由分析可知,滤渣A为SiO2 , 所以答案是:SiO2;(2)除锰过程中产生MnO(OH)2沉淀,根据电荷守恒应有氢离子生成,反应离子方程式为:Mn2++H2O2+H2O=MnO(OH)2↓+2H+ , 所以答案是:Mn2++H2O2+H2O=MnO(OH)2↓+2H+;(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制pH使铁离子沉淀完全,而Zn2+不能沉淀,故控制反应液pH的范围为3.3~5.4,
所以答案是:3.3~5.4;②除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是:先加入ZnS会将Fe3+还原为Fe2+ , 使铁元素难以除去,
所以答案是:先加入ZnS会将Fe3+还原为Fe2+ , 使铁元素难以除去;(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是,在搅拌下,将Na2C2O4缓慢加入到ZnCl2溶液中,
所以答案是:在搅拌下,将Na2C2O4缓慢加入到ZnCl2溶液中;(5)ZnC2O42H2O晶体中的ZnC2O4质量分数为 ![]() ×100%=80.95%,故A点完全失去结晶水,化学式为ZnC2O4 , 假设B点为ZnO,则残留固体占有的质量分数为
×100%=80.95%,故A点完全失去结晶水,化学式为ZnC2O4 , 假设B点为ZnO,则残留固体占有的质量分数为 ![]() ×100%=42.86%,故B点残留固体为ZnO,结合原子守恒可知还生成等物质的量的CO与CO2 . 300℃~460℃范围内,发生反应的化学方程式为:ZnC2O4
×100%=42.86%,故B点残留固体为ZnO,结合原子守恒可知还生成等物质的量的CO与CO2 . 300℃~460℃范围内,发生反应的化学方程式为:ZnC2O4 ![]() ZnO+CO↑+CO2↑,
ZnO+CO↑+CO2↑,
所以答案是:ZnC2O4 ![]() ZnO+CO↑+CO2↑.
ZnO+CO↑+CO2↑.

 天天练口算系列答案
天天练口算系列答案