题目内容
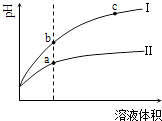
【题目】25℃时,用0.0500molL﹣1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000molL﹣1NaOH溶液所得滴定曲线如图.下列说法正确的是( ) 
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4﹣)=c(OH﹣)
B.点②所示溶液中:c(HC2O4﹣)+2c(C2O42﹣)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4﹣)>c(H2C2O4)>c(C2O42﹣)
D.滴定过程中可能出现:c(Na+)>c(C2O42﹣)=c(HC2O4﹣)>c(H+)>c(OH﹣)
【答案】BD
【解析】解:A.点①所示的溶液的体积25mL,草酸和氢氧化钠恰好完全反应,生成正盐草酸钠,草酸钠水解,所以溶液中,c(Na+)═2c(HC2O4﹣)+2c(H2C2O4)+2c(C2O42﹣)①,根据电荷守恒得:关系式为:c(Na+)+c(H+)═c(HC2O4﹣)+c(OH﹣)+2c(C2O42﹣)②,将①代入②得:c(H+)+2c(H2C2O4)+c(HC2O4﹣)=c(OH﹣),故A错误;
B.点②溶液中,溶液呈中性,c(H+)=c(OH﹣)①,根据电荷守恒得:关系式为:c(Na+)+c(H+)═c(HC2O4﹣)+c(OH﹣)+2c(C2O42﹣)②,将①代入②得c(HC2O4﹣)+2c(C2O42﹣)=c(Na+),故B正确;
C.点③所示的溶液的体积50mL,草酸过量,溶液溶质为NaHC2O4 , 溶液呈酸性,草酸氢根离子的电离大于草酸氢根离子的水解,所以c(Na+)>c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4),故C错误;
D.点①为草酸钠成碱性,点②溶液呈中性为草酸钠、草酸氢钠,点③溶液呈酸性,介于②和③之间,随着草酸的滴入,NaHC2O4逐渐增多,所以可出现c(Na+)>c(C2O42﹣)=c(HC2O4﹣)>c(H+)>c(OH﹣),故D正确;
故选BD.
25℃时,用0.0500molL﹣1H2C2O4(二元弱酸)溶液滴定25.00mL0.1000molL﹣1NaOH溶液,发生的反应为:H2C2O4+2NaOH=Na2C2O4+2H2O、H2C2O4+Na2C2O4=2NaHC2O4 .
A.点①表示滴入25.00mL0.0500molL﹣1H2C2O4(二元弱酸)溶液,恰好完全反应,生成正盐草酸钠,结合电荷守恒判断;
B.点②溶液中,溶液呈中性,c(H+)=c(OH﹣),结合电荷守恒判断;
C.点③滴入0.0500molL﹣1H2C2O4(二元弱酸)溶液50.00mL,溶液溶质为NaHC2O4 , 溶液呈酸性;
D.点①为草酸钠成碱性,点②溶液溶质为NaHC2O4、Na2C2O4呈中性,点③溶液,溶质为NaHC2O4 , 呈酸性,介于②和③之间溶液NaHC2O4逐渐增多,溶液呈酸性.

 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案【题目】以炼锌厂的烟道灰(主要成分为ZnO,另含少量Fe2O3、CuO、SiO2、MnO等)为原料可生产草酸锌晶体(ZnC2O42H2O). 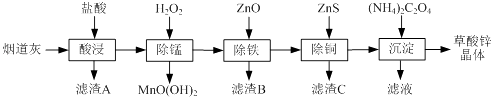
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 4.2 | 5.4 |
沉淀完全的pH | 3.3 | 9.7 | 6.7 | 8.2 |
请问答下列问题:
(1)滤渣A的主要成分为 .
(2)除锰过程中产生MnO(OH)2沉淀的离子方程式为 .
(3)①除铁(部分Cu2+可能被除去)时加入ZnO控制反应液pH的范围为 . ②上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是 .
(4)若沉淀过程采用Na2C2O4代替(NH4)2C2O4生产草酸锌晶体,合理的加料方式是 .
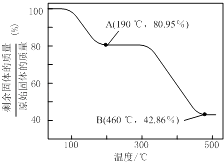
(5)将草酸锌晶体加热分解可得到一种纳米材料.加热过程中固体残留率随温度的变化如下图所示,300℃~460℃范围内,发生反应的化学方程式为