题目内容
17.硫在空气中燃烧生成气体A.把A溶于水得溶液B.向B中滴加溴水,溴水褪色,B变成C.在C里加Na2S产生气体D.把D通入B溶液得浅黄色沉淀E.按A、B、C、D、E顺序排列的是( )| A. | SO2、H2SO4、H2SO3、H2S、S | B. | SO2、H2SO3、H2SO4、H2S、S | ||
| C. | SO2、H2SO3、H2SO4、SO3、S | D. | SO2、H2SO3、H2SO4、SO2、S |
分析 将硫磺在空气中燃烧生成SO2,SO2与水反应生成H2SO3,向H2SO3中滴加溴水,发生氧化还原反应生成H2SO4;在H2SO4中加入Na2S产生气体H2S,若将H2S通入H2SO3溶液,可得沉淀S.
解答 解:将硫磺在氧气中燃烧生成SO2,SO2与水反应生成H2SO3,
H2SO3具有还原性,与具有氧化性的溴水反应生成H2SO4,
H2SO4的酸性比H2S强,加入Na2S可生成H2S,
H2S具有还原性,H2SO3具有氧化性,二者发生氧化还原反应生成单质S,
故选B.
点评 本题考查含硫物质的性质及综合应用,题目难度不大,注意含硫物质的化学性质,H2SO3与H2S的反应为H2SO3在中学阶段唯一表现氧化性的反应.

练习册系列答案
相关题目
15.对于Fe+H2SO4=FeSO4+H2↑反应,下列条件能加快化学反应速率的是( )
| A. | 升高温度 | B. | 加水 | C. | 改用98%的浓硫酸 | D. | 加入NaHCO3固体 |
5.下列对实验现象的预测不正确的是( )
| A. | 向Na2SiO3溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失 | |
| B. | 向Na2CO3饱和溶液中通入CO2溶液变浑浊,继续通入CO2,有晶体析出 | |
| C. | 向Ca(ClO)2溶液中通入CO2溶液变浑浊,再加入品红溶液,红色褪去 | |
| D. | 向Ca(OH)2溶液中通入CO2,溶液变浑浊,继续通入CO2至过量,浑浊消失,再加入过量NaOH溶液,溶液又变浑浊 |
12.下列反应一定能自发进行的是( )
| A. | 放热反应 | B. | 熵增加的反应 | ||
| C. | 熵增加的吸热反应 | D. | 熵增加的放热反应 |
2.北京2008年奥运会在开幕式之前举行的隆重的火炬接力仪式.火炬的可燃物为丁烷(C4H10).下列关于丁烷的说法中,不正确的是( )
| A. | 丁烷中碳、氢原子的个数比为4:10 | |
| B. | 丁烷中碳、氢两种元素的质量比是4:10 | |
| C. | 丁烷由碳、氢两种元素组成 | |
| D. | 一个丁烷分子由4个碳原子和10个氢原子构成 |
9.在A、B、C、D四个烧杯内分别放入0.1mol的Na、Na2O、Na2O2、NaOH,然后各加入100mL H2O,搅拌使固体完全溶解,则A、B、C、D的质量分数大小顺序为( )
| A. | A<B<C<D | B. | D<A<B=C | C. | A=D<B=C | D. | D<A<B<C |
7.FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某化学研究小组为探究在酒精喷灯加热条件下FeSO4分解的气体产物,进行了一系列实验.已知SO3的熔点是16.8℃,沸点是44.8℃.
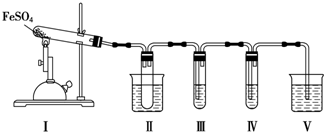
请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中,试管浸泡在50℃的水中,其目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
(3)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入适量硫酸,溶液立即变黄.
①上述反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
②为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:ABC(填序号).
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀.

请回答下列问题:
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中,试管浸泡在50℃的水中,其目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验中气体产物的成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中装有0.5mol•L-1BaCl2溶液 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中装有0.01mol•L-1酸性KMnO4溶液(或0.0l mol.L-1 溴水) |
①上述反应的离子方程式为2Fe2++ClO-+2H+═2Fe3++Cl-+H2O.
②为检验上述反应中的还原产物,请选择所需实验步骤,并按先后次序排列:ABC(填序号).
A.取一支试管,加入上述反应后的溶液少许
B.加入过量Ba(NO3)2溶液,出现白色沉淀
C.过滤;取滤液加入硝酸酸化的AgNO3溶液,出现白色沉淀.