题目内容
下列说法中正确的是( )
①干冰在升华时只破坏氢键
②极性分子中肯定含有极性键,则含有极性键的分子一定是极性分子
③离子化合物一定含有离子键,则共价化合物中一定不含有离子键
④VIIA族单质从上到下,熔沸点越来越高,则IA族单质的熔沸点也越来越高
⑤H2O分子间存在着氢键,故H2O分子比H2S分子稳定
⑥在熔融状态和水溶液中均不能导电的物质称为非电解质
⑦HClO4酸性比H2SO4酸性强,说明氯的非金属性比硫强.
①干冰在升华时只破坏氢键
②极性分子中肯定含有极性键,则含有极性键的分子一定是极性分子
③离子化合物一定含有离子键,则共价化合物中一定不含有离子键
④VIIA族单质从上到下,熔沸点越来越高,则IA族单质的熔沸点也越来越高
⑤H2O分子间存在着氢键,故H2O分子比H2S分子稳定
⑥在熔融状态和水溶液中均不能导电的物质称为非电解质
⑦HClO4酸性比H2SO4酸性强,说明氯的非金属性比硫强.
| A、①②③⑤ | B、②④⑥ | C、①③⑥ | D、③⑦ |
分析:①干冰为分子晶体,不含氢键;
②含有极性键的分子不一定是极性分子;
③含有离子键的化合物一定为离子化合物;
④晶体类型不同,熔沸点不变规律不同;
⑤氢键与分子的稳定性无关;
⑥应为化合物;
⑦元素的非金属性越强,对应的氢化物越稳定.
②含有极性键的分子不一定是极性分子;
③含有离子键的化合物一定为离子化合物;
④晶体类型不同,熔沸点不变规律不同;
⑤氢键与分子的稳定性无关;
⑥应为化合物;
⑦元素的非金属性越强,对应的氢化物越稳定.
解答:解:①干冰不含氢键,升华时克服范德华力,故错误;
②含有极性键的分子不一定是极性分子,如甲烷等,故错误;
③含有离子键的化合物一定为离子化合物,共价化合物只含共价键,故正确;
④IA族单质为金属降低,熔沸点从上到下逐渐降低,故错误;
⑤H2O分子比H2S分子稳定,是由于共价键键能较大,氢键与分子的稳定性无关,故错误;
⑥非电解质应为化合物,如不是化合价,则不是非电解质,故错误;
⑦元素的非金属性越强,对应的氢化物越稳定,故正确.
故选C.
②含有极性键的分子不一定是极性分子,如甲烷等,故错误;
③含有离子键的化合物一定为离子化合物,共价化合物只含共价键,故正确;
④IA族单质为金属降低,熔沸点从上到下逐渐降低,故错误;
⑤H2O分子比H2S分子稳定,是由于共价键键能较大,氢键与分子的稳定性无关,故错误;
⑥非电解质应为化合物,如不是化合价,则不是非电解质,故错误;
⑦元素的非金属性越强,对应的氢化物越稳定,故正确.
故选C.
点评:本题考查较为综合,涉及晶体类型、化学键以及物质的性质的递变规律,侧重于学生的分析能力的考查,为高频考点,注意相关基础知识的积累,难度不大.

练习册系列答案
 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
下列说法中正确的是( )
| A、进行钠的有关性质实验时,用剩的钠应放回原试剂瓶 | B、常用25.00 ml 碱式滴定管准确量取20.00 ml KMnO4溶液 | C、用湿润的淀粉碘化钾试纸可以鉴别NO2和Br2蒸气 | D、某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- |
Na3N和NaH都是离子化合物,与水反应都有气体生成,下列说法中正确的是( )
| A、两种物质的阴离子半径都比阳离子半径小 | B、溶于水,所得溶液都能使无色酚酞变红 | C、与水反应时,水都做氧化剂 | D、与盐酸反应都只生成一种盐 |
下列说法中正确的是( )
| A、用碱石灰除去氯气中的水 | B、碘化银是重要的感光材料,溴化银可用于人工降雨 | C、过氧化钠可用作潜艇里氧气的来源 | D、焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察 |
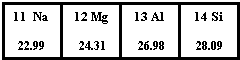 如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )
如图为元素周期表第三周期的一部分.据此判断下列说法中正确的是( )| A、Si元素的名称是硅,其核电荷数为14 | B、Mg原子的结构示意图是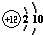 | C、Al的相对原子质量是26.98g | D、它们都属于金属元素 |
下列说法中正确的是( )
| A、O、Na、S元素的原子半径依次增大 | B、KOH、Mg(OH)2、Ba(OH)2的碱性依次增强 | C、H2SO4、H3PO4、HClO4的酸性依次增强 | D、F2、Cl2、Br2、I2的氧化性依次减弱 |