题目内容
已知A为常见的金属单质,根据如图所示的关系:
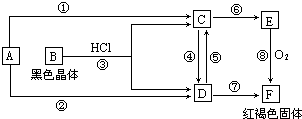
(1)B的化学式为:
(2)④的离子方程式:
(3)由E→F的实验现象为:

(1)B的化学式为:
Fe3O4
Fe3O4
.(2)④的离子方程式:
2Fe2++Cl2═2Fe3++2Cl-,
2Fe2++Cl2═2Fe3++2Cl-,
.(3)由E→F的实验现象为:
白色沉淀迅速变为灰绿色最后变为红褐色
白色沉淀迅速变为灰绿色最后变为红褐色
.写出⑧的化学方程式:4Fe(OH)2+O2+2H2O═4Fe(OH)3
4Fe(OH)2+O2+2H2O═4Fe(OH)3
.分析:由转化关系图可知,红褐色固体F为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,D为FeCl3,A为Fe,B为Fe3O4,然后结合物质的性质及化学用语来解答.
解答:解:由转化关系图可知,红褐色固体F为Fe(OH)3,则E为Fe(OH)2,C为FeCl2,D为FeCl3,A为Fe,B为Fe3O4,
(1)B为Fe3O4,故答案为:Fe3O4;
(4)④的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(3)E→F的实验现象为白色沉淀迅速变为灰绿色最后变为红褐色,反应⑧为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:白色沉淀迅速变为灰绿色最后变为红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
(1)B为Fe3O4,故答案为:Fe3O4;
(4)④的离子方程式为2Fe2++Cl2═2Fe3++2Cl-,故答案为:2Fe2++Cl2═2Fe3++2Cl-;
(3)E→F的实验现象为白色沉淀迅速变为灰绿色最后变为红褐色,反应⑧为4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:白色沉淀迅速变为灰绿色最后变为红褐色;4Fe(OH)2+O2+2H2O═4Fe(OH)3.
点评:本题考查无机物的推断,注意物质的颜色为解答本题的突破口,熟悉铁及其化合物的性质即可解答,注意氧化还原反应,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 ”表示上述相关元素的原子中除去最外层电子的剩余部分,“
”表示上述相关元素的原子中除去最外层电子的剩余部分,“ ”表示氢原子,小黑点“
”表示氢原子,小黑点“

