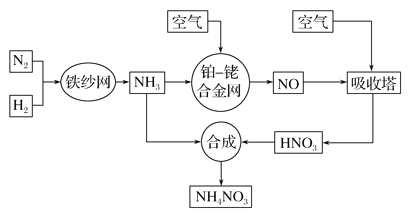
题目内容
【题目】(1)A、B、C三种可溶性化合物,它们的阳离子可能是Na+、Mg2+、Ag+,阴离子可能是NO3-、OH-、Cl-,分别取相同质量的三种化合物,溶解于水,配制相同体积的溶液, 其物质的量的浓度由大到小的顺序是A、B、C,则三种化合物化学式分别是:A______、B______、C_________________。
(2)有以下3种物质:①Na2CO3固体②Fe(OH)3胶体③硫化锑(Sb2S3)胶体
填空回答:
A.①既是钠盐又是碳酸盐,对该物质的分类方法是___________________________。
B.实验室制备②的化学方程式为_____________________________________。
C.橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,证明Sb2S3胶粒带_____电荷。
【答案】 NaOH MgCl2 AgNO3 交叉分类法 FeCl3+ 3H2O![]() Fe(OH)3(胶体)+3HCl 负
Fe(OH)3(胶体)+3HCl 负
【解析】试题分析:(1)A、B、C三种可溶性化合物,它们的阳离子可能是Na+、Mg2+、Ag+,阴离子可能是NO3-、OH-、Cl-,氢氧化物只能是氢氧化钠可溶,氯化镁可溶、硝酸银可溶。分别取相同质量的三种化合物,溶解于水,配制相同体积的溶液, 其物质的量的浓度由大到小的顺序是A、B、C,则三种化合物的摩尔质量从小到大的顺序为A、B、C,所以其化学式分别是NaOH、MgCl2、AgNO3。
(2)A.①Na2CO3既是钠盐又是碳酸盐,对该物质的分类方法是交叉分类法。
B.实验室制备②Fe(OH)3胶体的化学方程式为FeCl3+ 3H2O![]() Fe(OH)3(胶体)+3HCl。
Fe(OH)3(胶体)+3HCl。
C.橘红色的硫化锑(Sb2S3)胶体,装入U型管,插入电极后通直流电,发现阳极附近橘红色加深,证明Sb2S3胶粒带负电荷。

 阅读快车系列答案
阅读快车系列答案【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:

已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为___________。
(2)根据实验目的,选择合适的实验步骤:①→____________。
①组装好装置,_________________(填写实验操作名称);
②将A装置中的纯铁丝小心向下插入苯和液溴的混合液中;
③点燃B装置中的酒精灯,用小火缓缓对锥形瓶加热10分钟;
④向烧瓶中加入一定量苯和液溴,向锥形瓶中加入无水乙醇至稍高于进气导管口处,向U形管中加入蒸馏水封住管底,向水槽中加人冰水。
(3)简述实验中用纯铁丝代替铁粉的优点:_________________。
(4)反应完毕后,U形管内的现象是_________;分离溴乙烷时所需的玻璃仪器是___________。
(5)假设最初取用的无水乙醇是71.9 mL,最后得到的纯净的溴乙烷是66.2 mL,则溴乙烷的产率为______________(保留两位小数)。