题目内容
【题目】(1) 3.01×1023个CO2分子中含_____________mol氧原子,在标准状况下其体积为____L,0.4 molOH-的中有 ______个电子。
(2)实验中需取0.1mol CuSO4配制溶液,若用CuSO4 5H2O替代,则应称取CuSO4 5H2O的质最为___g。
(3)同温同压下,等质量的N2和CO2所含分子数比为_____,体积比为________。
(4)某气体在标准状况下的密度为1.25g/L,则28g该气体所含有的分子数为_____________。
(5)在标准状况下22.4L由氮气和氧气组成的混合气体,其质量为30g,则其中氧气的质量为____g。
(6)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L的稀硫酸l00mL,配制过程中需量取浓硫酸____mL。
【答案】 1 11.2 4NA或2.408×1024 25.0 (25) 11:7 11:7 NA (或 6.02×1023) 16 5.4
【解析】(1) 3.01×1023个CO2的物质的量为0.5mol,含1mol氧原子,在标准状况下其体积为11.2 L。OH-有10个电子 ,0.4 mol OH-的中有4NA(或2.408×1024)个电子。
(2)实验中需取0.1mol CuSO4配制溶液,若用CuSO4 5H2O替代,则应称取0.1mol CuSO4 5H2O,其质最为25.0g。
(3)N2和CO2的摩尔质量之比为7:11。等质量的N2和CO2,其物质的量之比与摩尔质量成反比,所以物质的量之比为11:7,所含分子数之比等于物质的量之比,为11:7;同温同压下,体积比等于物质的量之比,为11:7。
(4)某气体在标准状况下的密度为1.25g/L,则该气体的摩尔质量为1.25g/L![]() L/mol=28g/mol,所以28g该气体的物质的量为1mol,所含有的分子数为NA (或 6.02×1023)。
L/mol=28g/mol,所以28g该气体的物质的量为1mol,所含有的分子数为NA (或 6.02×1023)。
(5)在标准状况下22.4L由氮气和氧气组成的混合气体,其物质的量为1mol,质量为30g,则32n(O2)+28[1-n(O2)]=30,解得n(O2)=0.5mol,所以其中氧气的质量为16g。
(6)用98%的浓硫酸(ρ=1.84 g/cm3)配制1 mol/L的稀硫酸l00mL,先求c(H2SO4)=![]() mol/L =18.4mol/L,配制过程中需量取浓硫酸V =
mol/L =18.4mol/L,配制过程中需量取浓硫酸V =![]() 5.4mL。
5.4mL。

 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案【题目】二氧化氯(ClO2)是极易溶于水且不与水发生化学反应的黄绿色气体,沸点为11℃,可用于处理含硫废水。某小组在实验室中探究ClO2与Na2S的反应。回答下列问题:
(l)ClO2的制备:(已知:SO2+2NaClO3+H2SO4=2ClO2↑+2NaHSO4)
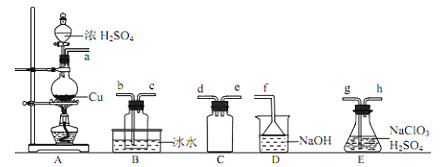
①装置A中反应的化学方程式为_______________。
②欲收集干燥的ClO2,选择上图中的装置,其连接顺序为 a→_________(按气流方向,用小写字母表示)
③装置D的作用是_________。
(2)ClO2与 Na2S 的反应
将上述收集到的ClO2用 N2稀释以增强其稳定性,并将适量的稀释后的ClO2通入上图所示装置中充分反应,得到无色澄清溶液。一段时间后,通过下列实验探究 I 中反应的产物。
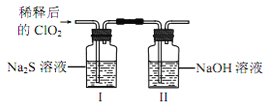
操作步骤 | 实验现象 | 结论 |
取少量Ⅰ中溶液于试管甲中, 加入Ba(OH)2溶液,振荡 | ①_________ | 有硫酸根离子生成 |
另取少量Ⅰ中溶液于试管乙中, 滴加品红溶液和盐酸 | 品红溶液不翅色 | ② 无_____生成 |
若在试管甲中继续加Ba(OH)2溶液至 过量,静置,取上层清液于试管丙③______ | 有白色沉淀生成 | 有Cl-生成 |
④ClO2与Na2S反应的离子方程式为__________。用于处理含硫废水时,ClO2相对于Cl2的优点是____________(任写2条)。
