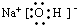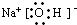题目内容
同一短周期的X、Y、Z三种元素,其最高价氧化物对应的水化物呈酸性,酸性强弱为HXO4>H2YO4>H3ZO4,则下列判断正确的是( )
分析:同周期元素的原子从左到右,最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱;
同周期元素的原子从左到右,原子半径逐渐减小,得电子能力逐渐增强,氢化物的稳定性逐渐增强.阳离子的氧化性增强,阴离子的还原性逐渐减弱.
同周期元素的原子从左到右,原子半径逐渐减小,得电子能力逐渐增强,氢化物的稳定性逐渐增强.阳离子的氧化性增强,阴离子的还原性逐渐减弱.
解答:解:非金属性越强,最高价氧化物对应水化物的酸性越强,最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z.
A、同周期元素的原子从左到右,原子半径逐渐减小,非金属性增强,所以原子半径:X<Y<Z,故A错误;
B、最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,故B正确;
C、非金属性越强,氢化物越稳定,由于非金属性X>Y>Z,所以气态氢化物的稳定性:HX>H2Y>ZH3,故C错误;
D、元素非金属性越强,阴离子的还原性越弱,由于非金属性X>Y>Z,所以阴离子的还原性:Z3->Y2->X-,故D错误.
故选:B.
A、同周期元素的原子从左到右,原子半径逐渐减小,非金属性增强,所以原子半径:X<Y<Z,故A错误;
B、最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,故B正确;
C、非金属性越强,氢化物越稳定,由于非金属性X>Y>Z,所以气态氢化物的稳定性:HX>H2Y>ZH3,故C错误;
D、元素非金属性越强,阴离子的还原性越弱,由于非金属性X>Y>Z,所以阴离子的还原性:Z3->Y2->X-,故D错误.
故选:B.
点评:本题考查元素周期律知识,题目难度不大,注意掌握元素周期律的主要递变规律,注意由化学式可以确定具体的元素.

练习册系列答案
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案
相关题目
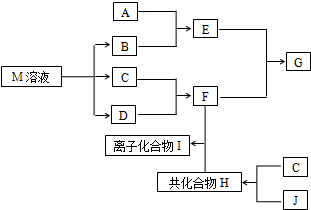 短周期元素的单质C、D、J在通常状况下均为气态,且常见双原子单质分子,J分子共价键最多;H分子中含10个电子;物质M由同一短周期的X、Y两种元素组成,X原子最外层电子数是最内层电子数的1/2,Y元素最高正价与它的负价代数和为6.M与其它物质的转化关系如图(部分产物及反应条件已略去)则:
短周期元素的单质C、D、J在通常状况下均为气态,且常见双原子单质分子,J分子共价键最多;H分子中含10个电子;物质M由同一短周期的X、Y两种元素组成,X原子最外层电子数是最内层电子数的1/2,Y元素最高正价与它的负价代数和为6.M与其它物质的转化关系如图(部分产物及反应条件已略去)则: