题目内容
【题目】(1)已知下列热化学方程式:
CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1=+260kJ/mol
2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
请写出用CH4与O2反应生成CO和H2的的热化学方程式______________。
(2)在一定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g),其化学平衡常数K与t的关系如下表,请完成下列问题:
2NH3(g),其化学平衡常数K与t的关系如下表,请完成下列问题:
t/K | 298 | 398 | 498 |
K/(mol/L)-2 | 4.1×106 | K1 | K2 |
①比较K1、K2的大小,K1__________K2(填写“>”“=”或“<”)。
②下列各项能作为判断该反应达到化学平衡状态的依据的是_________(填序号字母)。
A.容器内N2、H2、NH3的浓度之比为1:3:2 B.3v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
③若上述反应达到平衡时,N2、H2、NH3的浓度之比为1:3:2,再向容器中按物质的量之比1:3:2通入N2、H2、NH3,与原平衡相比,N2的物质的量浓度______(填“增大”或“减小”或“不变”,下同),NH3的体积分数__________。
(3)高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)![]() Fe(s)+CO2(g) △H>0。
Fe(s)+CO2(g) △H>0。
①其平衡常数可表示为_____________。
②已知1100℃时K=0.263,1100℃时测得高炉中c(CO2)=0.025 mol/L,c(CO)=0.1mol/L,此时CO气体的转化率为_________(用百分数表示),该反应是否处于化学平衡状态____(选填“是”或“否”),此时,化学反应速率是υ正____υ逆(选填“大于”、“小于”或“等于”)。
【答案】2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-46kJ/mol > BC 增加 增加 K=![]() 20% 否 大于
20% 否 大于
【解析】
(1)根据盖斯定律计算2CH4(g)+O2(g)=2CO(g)+4H2(g)的焓变△H,进而写出热化学方程式;
(2)①根据化学平衡常数是平衡时生成物浓度幂之积与反应物浓度幂之积的比,及合成氨的反应是放热反应,升高温度,平衡逆向移动分析;
②根据反应达到平衡状态时,正、逆反应速率相等及反应体系中各物质的百分含量不变及混合气体的总压强、总体积、总物质的量不随时间的改变而改变等判断平衡状态;
③再向容器中按物质的量之比为1:3:2通入N2、H2、NH3,相当于增大压强,平衡向正方向移动,据此判断;
(3)①化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
②转化率=![]() ×100%;根据浓度商Qc与K的大小关系判断:若Qc>K,则反应逆向进行;若Qc=K,则反应不移动;若Qc<K,则反应正向进行。
×100%;根据浓度商Qc与K的大小关系判断:若Qc>K,则反应逆向进行;若Qc=K,则反应不移动;若Qc<K,则反应正向进行。
(1)CH4与O2反应生成CO和H2的化学方程式为2CH4(g)+O2(g)=2CO(g)+4H2(g),则
①CH4(g)+CO2(g)=2CO(g)+2H2(g) △H1=+260kJ/mol
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol
根据盖斯定律,将①×2+②,整理可得:2CH4(g)+O2(g)=2CO(g)+4H2(g)的焓变△H=(+260kJ/mol)×2+(-566kJ/mol)=-46kJ/mol,因此该反应的热化学方程式为2CH4(g)+O2(g)=2CO(g)+4H2(g) △H=-46kJ/mol;
(2)①合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g) △H<0,正反应是放热反应,升高温度,化学平衡向吸热的逆反应方向移动,则化学平衡常数会减小,所以K1>K2;
2NH3(g) △H<0,正反应是放热反应,升高温度,化学平衡向吸热的逆反应方向移动,则化学平衡常数会减小,所以K1>K2;
②A.平衡时反应混合物中各组分的含量保持不变,但容器内N2、H2、NH3的浓度之比不一定为1:3:2,因此该特征不能作为判断平衡的标志,A错误;
B.平衡时不同物质表示正、逆反应速率之比等于反应计量数之比,即3v(N2)正=v(H2)逆的状态是反应达到平衡的状态,B正确;
C.反应前后气体体积减小,若压强不变,说明反应达到平衡,C正确;
D.反应前后气体的质量不变,容器的体积不变,所以容器内混合气体密度始终不变,因此不能根据混合气体的密度保持不变判断反应处于平衡的状态,D错误;
故合理选项是BC;
③再向容器中按物质的量之比为1:3:2通入N2、H2、NH3,相当于增大压强,化学平衡向气体体积减小的正反应方向移动,所以NH3的体积分数增大;虽然化学平衡向正反应方向移动,但平衡移动的趋势是微弱的,因此达到新的平衡时N2的物质的量浓度增大;
(3)①反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)的化学平衡常数K=
Fe(s)+CO2(g)的化学平衡常数K=![]() ;
;
②某一时刻高炉中c(CO2)=0.025 mol/L,c(CO)=0.![]() ×100%=20%;浓度商Qc=
×100%=20%;浓度商Qc=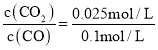 =0.25<0.263=K,所以反应没有达到平衡状态,此时化学反应向正反应分析进行,v正>v逆。
=0.25<0.263=K,所以反应没有达到平衡状态,此时化学反应向正反应分析进行,v正>v逆。

 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案【题目】I.已知25℃时,醋酸、碳酸、氢氰酸的电离平衡常数如下表:(单位省略)
醋酸 | 碳酸 | 氢氰酸 |
Ka=1.7×10 | Ka1=4.2×10 | Ka=6.2×10 |
(1)写出碳酸的第一步电离方程式__________________________________。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2CO3溶液、③CH3COONa 溶液,pH由大到小的顺序为_____________________ (填序号)。
(3)25℃时,向NaCN溶液中通入少量CO2,反应的离子方程式为_______________。
(4)将浓度为0.02mol/L的HCN 与0.01mol/LNaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN![]() ),下列关系正确的是_______。
),下列关系正确的是_______。
a.c(H+)>c(OH![]() ) b.c(H+)+c(HCN)=c(OH
) b.c(H+)+c(HCN)=c(OH![]() ) c.c(HCN)+c(CN
) c.c(HCN)+c(CN![]() )=0.01mol/L
)=0.01mol/L
II.请用有关电解质溶液的知识回答下列问题:
(1)某温度下纯水的c(H+)=4.0×10![]() mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10
mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10![]() mol/L,则此溶液中由水电离产生的c(H+)=_________。
mol/L,则此溶液中由水电离产生的c(H+)=_________。
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10![]() 。某硫酸铜溶液里c(Cu2+)=0.02 mol·L
。某硫酸铜溶液里c(Cu2+)=0.02 mol·L![]() ,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
(3)向含有相同浓度Fe2+、Hg2+的溶液中滴加Na2S溶液,先生成______沉淀(填化学式)。在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式______________________。(Ksp(FeS)=6.3×10![]() ,Ksp(HgS)=6.4×10
,Ksp(HgS)=6.4×10![]() )
)