题目内容
12.取1.43g Na2CO3•10H2O溶于水配成100ml溶液,求:(1)Na2CO3物质的量浓度为0.05mol/L;
(2)Na+ 的质量为0.23g;
(3)取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求加入蒸馏水的体积5ml(设稀释时,对溶液体积的影响忽略不计).
分析 (1)根据n=$\frac{m}{M}$计算1.43gNa2CO3•10H2O的物质的量,n(Na2CO3)=n(Na2CO3•10H2O),根据c=$\frac{n}{V}$计算所得溶液中Na2CO3的物质的量浓度;
(2)n(Na+)=2n(Na2CO3•10H2O),根据m=nM计算Na+ 的质量;
(3)稀释后0.04mol/L的碳酸钠溶液中钠离子的浓度为0.08mol/L,根据稀释定律计算稀释后溶液的体积,进而计算加入蒸馏水的体积.
解答 解:(1)1.43gNa2CO3•10H2O的物质的量=$\frac{1.43g}{286g/mol}$=0.005mol,n(Na2CO3)=n(Na2CO3•10H2O)=0.005mol,配成100mL溶液,Na2CO3物质的量浓度为$\frac{0.005mol}{0.1L}$=0.05mol/L,
故答案为:0.05;
(2)溶液中n(Na+)=2n(Na2CO3•10H2O)=0.005mol×2=0.01mol,则Na+ 的质量为0.01mol×23g/mol=0.23g,
故答案为:0.23;
(3)所得溶液中Na+的物质的量浓度=$\frac{0.01mol}{0.1L}$=0.1mol/L,稀释后0.04mol/L的碳酸钠溶液中钠离子的浓度为0.08mol/L,
令稀释后溶液的体积为VmL,根据稀释定律,有:0.1mol/L×20mL=0.08mol/L×V mL,
解得V=25,
故加入蒸馏水的体积为25mL-20mL=5mL,
答:需要加入水的体积为5mL.
点评 本题考查物质的量浓度有关计算,比较基础,注意对物质的量浓度定义式的理解与灵活应用.

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目
2.下列化合物中,属于芳香族化合物,且属于醇类的是( )
| A. | 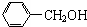 | B. |  | C. |  | D. | CH3OH |
3.铁的发现和大规模使用,是人类发展史上的一个光辉里程碑,它把人类从石器时代、青铜器时代带到了铁器时代,推动了人类文明的发展.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
(2)铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:
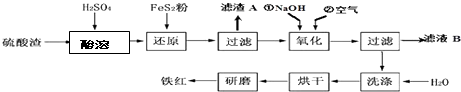
①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:1FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
如果pH过大,可能引起的后果是Al3+、Mg2+形成沉淀,使制得的铁红不纯(几种离子沉淀的pH见表);滤液B可以回收的物质有(写化学式)Na2SO4、Al2(SO4)3、MgSO4.
(1)高铁酸钠(Na2FeO4)是水处理过程中的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原成三价铁离子达到净水的目的.按要求回答下列问题:
高铁酸钠主要通过如下反应制取:2Fe(OH)3+3NaClO+4NaOH═2Na2FeO4+3X+5H2O,则X的化学式NaCl,反应中被氧化的物质是Fe(OH)3(写化学式).
(2)铁红颜料跟某些油料混合,可以制成防锈油漆.以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如图:

①酸溶过程中Fe2O3与稀硫酸反应的化学方程式为Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;“滤渣A”主要成份的化学式为SiO2.
②还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,请完成该反应的离子方程式:1FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+.
③氧化过程中,O2、NaOH与Fe2+反应的离子方程式为4Fe2++O2+2H2O+8OH-=4Fe(OH)3↓.
④为了确保铁红的质量和纯度,氧化过程需要调节溶液的pH的范围是3.2~3.8,
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
4.下列有关化学用语的表示正确的是( )
| A. | 钠原子的结构示意图为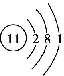 | B. | 过氧化氢的电子式为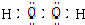 | ||
| C. | 聚乙烯的结构简式为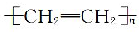 | D. | 淀粉和纤维素的实验式都为CH2O |
1.下列溶液中溶质物质的量浓度为0.1mol•L-1的是( )
| A. | 将4.0gNaOH溶解于1L水中配成NaOH溶液 | |
| B. | 将6.2gNa2O溶于水并配成2L溶液 | |
| C. | 将0.5mol•L-1NaNO3溶液100mL加热蒸发掉50g水后的溶液 | |
| D. | 1L含K+为0.1mol的K2SO4溶液 |
2.分子式为C10H14的可能结构中只有一个取代基且含有苯环的结构共有( )
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 6种 |