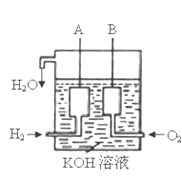
题目内容
【题目】目前我国研制的稀土催化剂催化转化汽车尾气示意图如图:
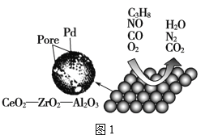
(1)Zr原子序数为40,价电子排布式为___。图1中属于非极性的气体分子是___。
(2)①氟化硼(BF3)是石油化工的重要催化剂。BF3中B-F比BF![]() 中B—F的键长短,原因是___。
中B—F的键长短,原因是___。
②乙硼烷(B2H6)是用作火箭和导弹的高能燃料,氨硼烷(H3NBH3)是最具潜力的储氢材料之一。
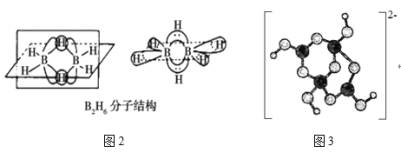
B2H6的分子结构如图2所示,其中B原子的杂化方式为___。
③H3NBH3的相对分子质量与B2H6相差不大,但是H3NBH3的沸点却比B2H6高得多,原因是__。
④硼酸盐是重要的防火材料。图3是硼酸钠晶体中阴离子(含B、O、H三种元素)的结构,该晶体中含有的化学键有__。
A.离子键 B.极性键 C.非极性键 D.配位键 E.金属键
(3)CO与Ni可生成羰基镍[Ni(CO)4],已知其中镍的化合价为0,[Ni(CO)4]的配体中配位原子是___。
(4)为了节省贵金属并降低成本,也常用钙钛矿型复合氧化物作为催化剂。一种复合氧化物结构如图4所示,则与每个Sr2+紧邻的O2-有___个。
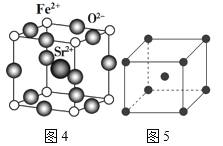
(5)与Zr相邻的41号元素Nb金属的晶格类型为体心立方晶格(如图5所示),原子半径为apm,相对原子质量为b,阿伏加德罗常数为NA,试计算晶体铌的密度为___g·cm-3(用来a、b、NA表示计算结果)。
【答案】4d25s2 O2、N2、CO2 BF3中B采用sp2杂化,BF4-中B采用sp3杂化,s轨道成分越多,电子云重叠程度越大,键长越短。(或BF3中除了σ键,还有(Π46)大π键) sp3 H3NBH3分子间存在氢键,分子间作用力更大 ABD C 12 ![]()
【解析】
(1)Zr原子序数为40,原子核外有40个电子,根据核外电子排布规律可得其基态原子的核外电子排布为[Kr]4d25s2,价电子排布为4d25s2;O2、N2均为双原子分子构成的气体,属于非极性分子,CO2分子为直线形,正负电荷中心重合,属于非极性分子;
(2)①BF3中B原子价层电子对数为3,采用sp2杂化,BF![]() 中B原子中心价层电子对数为4,采用sp3杂化,s轨道成分越多,电子云重叠程度越大,键长越短(或BF3中除了σ键,还有(Π46)大π键);
中B原子中心价层电子对数为4,采用sp3杂化,s轨道成分越多,电子云重叠程度越大,键长越短(或BF3中除了σ键,还有(Π46)大π键);
②据图可知B2H6分子中每个B原子和4个氢原子形成4个σ键,价层电子对数为4,所以为sp3杂化;
③N的电负性较大,所以H3NBH3分子间存在氢键,分子间作用力更大,沸点更高;
④硼酸钠晶体中有硼酸根和钠离子之间的离子键,阴离子中O原子和B原子、O原子和H原子之间存在极性键;B的最外层电子数为3,据图可知部分B原子形成4个共价键,所以其中有配位键,综上所述存在离子键、极性键、配位键,所以选ABD;
(3)[Ni(CO)4]的配体为CO,C原子和O原子均含有孤电子对,但C的电负性较小,更容易给出电子,所以配位原子为C;
(4)Sr2+在晶胞的体心,与之紧邻的O2-在晶胞的棱上,所以每个Sr2+紧邻的O2-有12;
(5)体心立方堆积模型中,位于体对角线上的3个原子相切,设晶胞的棱长为r,则有![]() =4a,解得r=
=4a,解得r=![]() a pm,则晶胞的体积V=
a pm,则晶胞的体积V=![]() pm3;根据均摊法晶胞中Nb原子的个数为
pm3;根据均摊法晶胞中Nb原子的个数为![]() =2,所以晶胞的质量为
=2,所以晶胞的质量为![]() g,所以晶胞密度为
g,所以晶胞密度为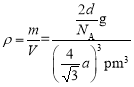 =
=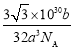 g/cm3。
g/cm3。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
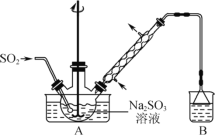
综合自测系列答案【题目】下列有关实验现象和解释或结论都正确的是( )
选项 | 实验操作 | 现象 | 解释或结论 |
A | 取硫酸催化淀粉水解的反应液,滴入少量新制 | 有砖红色沉淀生成 | 葡萄糖具有还原性 |
B |
| 有白色絮状沉淀生成 | 二者水解相互促进生成氢氧化铝沉淀 |
C | 将充满 | 红棕色变深 | 反应 |
D | 向 | 得到红褐色透明液体 | 得到 |
A.AB.BC.CD.D