题目内容
【题目】Co2O3常用于作氧化剂,在生产中有重要应用。
(1)一定条件下,0.996gCo2O3与15.00mL0.1mol·L-1的Na2S2O3溶液恰好完全反应,生成Co2+和一种含硫物质,该含硫物质中硫元素的化合价是___。
(2)Co2O3、PbO2、KMnO4均可与浓盐酸反应生成Cl2,同时分别生成Co2+、Pb2+和Mn2+。若生成等物质的量的Cl2,所需Co2O3、PbO2和KMnO4的物质的量之比为___。
(3)为测定某Co2O3样品中Co2O3的纯度(杂质不参与反应),现进行如下实验:
步骤1:称取样品2.000g于锥形瓶中,加入足量硫酸和50mL0.5000mol·L-1FeSO4溶液充分反应。
步骤2:向步骤1所得溶液中逐滴滴加0.0500mol·L-1KMnO4标准溶液至终点,消耗KMnO4标准溶液的体积为20.00mL。
已知步骤1、2中所涉及物质的转化分别为:Co3+![]() Co2+、MnO
Co2+、MnO![]()
![]() Mn2+
Mn2+
通过计算确定Co2O3样品中Co2O3的质量分数___(写出计算过程)。
【答案】+6 5:5:2 83%
【解析】
(1)~(2)均体现Co2O3的氧化性,可通过得失电子数守恒求解;
(3) 可实验中加入的亚铁离子和Co2O3与KMnO4分别发生氧化还原反应,按消耗的0.0500mol·L-1KMnO4标准溶液的体积,计算出和它反应的亚铁离子的量,则另一部分亚铁离子被Co2O3氧化,按关系式即可计算出某Co2O3样品中Co2O3的纯度,据此回答;
(1)一定条件下,0.996gCo2O3的物质的量为![]() =0.006mol,则反应中Co2O3得到电子为0.006mol×2=0.012mol ,则15.00mL0.1mol·L-1的Na2S2O3溶液失去的电子为0.012mol ,1mol硫原子失去的电子为
=0.006mol,则反应中Co2O3得到电子为0.006mol×2=0.012mol ,则15.00mL0.1mol·L-1的Na2S2O3溶液失去的电子为0.012mol ,1mol硫原子失去的电子为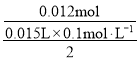 =4mol,则硫元素化合价升4价,所得产物中含硫物质中硫元素的化合价是+6;
=4mol,则硫元素化合价升4价,所得产物中含硫物质中硫元素的化合价是+6;
答案为:+6;
(2)Co2O3、PbO2、KMnO4均可与浓盐酸反应生成Cl2,同时分别生成Co2+、Pb2+和Mn2+。则反应关系式分别为:![]() 、
、![]() 和
和![]() ,因为生成等物质的量的Cl2,假设得5mol Cl2,则三个反应中转移电子10mol,所需Co2O3、PbO2和KMnO4的物质的量分别为5mol、5mol和2mol,则Co2O3、PbO2和KMnO4的物质的量之比为5:5:2;
,因为生成等物质的量的Cl2,假设得5mol Cl2,则三个反应中转移电子10mol,所需Co2O3、PbO2和KMnO4的物质的量分别为5mol、5mol和2mol,则Co2O3、PbO2和KMnO4的物质的量之比为5:5:2;
答案为:5:5:2;
(3)测定某Co2O3样品中Co2O3的纯度的实验中:步骤1: 2.000g样品在足量硫酸中溶解并和50mL0.5000mol·L-1FeSO4溶液充分反应,Co3+把亚铁离子氧化后亚铁离子还有剩余,步骤2中,多余的亚铁离子被20.00mL 0.0500mol·L-1KMnO4标准溶液反应完全,则
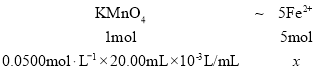 ,得x=0.00500mol ,
,得x=0.00500mol ,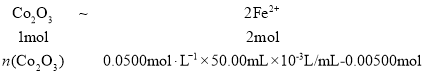 ,则
,则![]() =0.0100mol,
=0.0100mol,![]() =0.0100mol×166g/mol=1.66g,则Co2O3样品中Co2O3的纯度=
=0.0100mol×166g/mol=1.66g,则Co2O3样品中Co2O3的纯度=![]() =83%;
=83%;
答案为:83%。