��Ŀ����
����Ŀ�����ǻ��õļ�������غ����������أ�K2O�����������أ�K2O2���ͳ������أ�KO2���ȶ��ֻ����
��1���غ�����ط�Ӧ���Ƶ�K2O��10K+2KNO3��6K2O+N2����39.0g����10.1g����س�ַ�Ӧ����K2O������Ϊg��
��2��ij����������Ʒ�������������������ʲ�������Ϊ0.28������Ʒ��K2O2����������Ϊ ��
��3���������غͶ�����̼��Ӧ����������4KO2+2CO2��2K2CO3+3O2������ҽԺ����DZˮ���߿շ�����������������13.2L����״����CO2��KO2��Ӧ�����������Ϊ18.8L ����״���������㷴Ӧ���ĵ�KO2��������
��4��KO2������600�沿�ַֽ�õ�����A��6.30g����A������ն�����̼����̼��ز���������1.12L����״��������ȷ������A�м�������ԭ�Ӹ���֮�ȣ��������Aֻ�������ֻ����д�����п��ܵĻ�ѧʽ������A�����ֻ���������ʵ���֮�ȣ�
���𰸡�
��1��28.2
��2��96.25%
��3���⣺
4KO2+ | 2CO2 | �� | 2K2CO3+ | 3O2 | ��V |
4mol | 44.8L | 67.2L | 22.4L | ||
n | 5.6L |
n= ![]() =1mol��
=1mol��
m��KO2��=1mol��71g/mol=71g��
�𣺷�Ӧ���ĵ�KO2������Ϊ71g��
��4���⣺��A��ƽ����ѧʽΪ KxOy��
KxOy + |
| �T |
|
|
39x+16y | 11.2��y��0.5x�� | |||
6.3 | 1.12 |
![]() =
= ![]()
���x��y=2��3��
����n��K����n��O��=2��3��
����A�м�������ԭ�Ӹ���֮��2��3��
��n��K����n��O��=2��3�������û�ѧʽ����Ϊ��KO2��K2O2 ��KO2��K2O��
����ԭ���غ㷨�ɵ�n��KO2����n��K2O2��=2��1��n��KO2����n��K2O��=4��1��
��A�м�������ԭ�Ӹ���֮��Ϊ2��3��K2O2��KO2 1��2��K2O��KO2 1��4��
���������⣺��1��n��K��= ![]() =1mol��n��KNO3��=
=1mol��n��KNO3��= ![]() =0.1mol���ɷ���ʽ10K+2KNO3��6K2O+N2��֪��K�������������ȫ��Ӧ����Ӧ����0.3molK2O������Ϊ��0.3mol��94g/mol=28.2g�����Դ��ǣ�28.2����2��K2O2��K2O2������������110��32��ij����������Ʒ�������������������ʲ�������Ϊ0.28������Ʒ��K2O2����������Ϊ0.28��
=0.1mol���ɷ���ʽ10K+2KNO3��6K2O+N2��֪��K�������������ȫ��Ӧ����Ӧ����0.3molK2O������Ϊ��0.3mol��94g/mol=28.2g�����Դ��ǣ�28.2����2��K2O2��K2O2������������110��32��ij����������Ʒ�������������������ʲ�������Ϊ0.28������Ʒ��K2O2����������Ϊ0.28�� ![]() ��100%=96.25%�����Դ��ǣ�96.25%��
��100%=96.25%�����Դ��ǣ�96.25%��

����Ŀ������Ԫ�����ڱ���һ���֣���Ա��еĢ١�����Ԫ�أ���Ԫ�ط��Ż�ѧʽ��ջش��������⣺
���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
�� | �� | �� | ||||||
�� | �� | �� | �� | �� | �� | �� | ||
�� | �� | �� |
��1���ڢۡ���Ԫ���У�ԭ�Ӱ뾶������ �� �����ӵ�ԭ�ӽṹʾ��ͼΪ
��2��д���ݺ͢�����������Ӧˮ����䷢����Ӧ�����ӷ���ʽ�� ��
��3����Ҫ��д�������������ʵĵ���ʽ���ٵĵ�������Ĺ���������
��4���ڢ����ĵ����У���ѧ���ʽϻ��õ��� �� ����ʲô��ѧ��Ӧ˵������ʵ��д����Ӧ�Ļ�ѧ����ʽ���� ��
��5�����õ���ʽ��ʾ�ܺ͢���ɵĻ�������γɹ��� ��
����Ŀ��A��B��C��D��E��F���ֻ��������A��B��C��D��E���ɶ�����Ԫ����ɣ���ɫ��Ӧ��Ϊ��ɫ��B��C��E��������Ԫ����ɣ�B��C�����Ԫ����ͬ����C��Ħ��������B��80g/mol���ش�
��1�����廯����AΪdz��ɫ��ĩ���û������к��еĻ�ѧ��Ϊ_______
A.���Ӽ� B.���Թ��ۼ� C.�Ǽ��Թ��ۼ� D.���
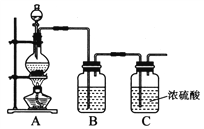
��2���±�ΪB��Fʵ��IJ�������
���ں�B����Һ�м���ϡH2SO4������dz��ɫ���Ǻ�ʹ����ʯ��ˮ����ǵ���ɫ�д̼�����ζ������ |
��20mL��ˮ�еμ�F�ı�����Һ1��2mL����Һ��ʺ��ɫ�����ü���������ж����ЧӦ�� |
д��B��ϡH2SO4��Ӧ�����ӷ���ʽ________
д�����з�Ӧ�Ļ�ѧ����ʽ________
��3������6������Mn2+��MnO 4-��H+��H2O��X2Y 82-��C�к��е������ӣ���XY 42-���һ�����ӷ���ʽ����֪Mn2+Ϊ��ԭ�����õ�1mol MnO 4- �������������ʵ���Ϊ________ mol
��4��������D��E�ת��D ![]() E������D��ExH2O�Ļ����13.04g�����ȵ���ȫ��Ӧ���������ͨ��ŨH2SO4����3.42g��ʣ������ͨ����ʯ������2.20g����������D������Ϊ________ g��ExH2O�Ļ�ѧʽΪ________��
E������D��ExH2O�Ļ����13.04g�����ȵ���ȫ��Ӧ���������ͨ��ŨH2SO4����3.42g��ʣ������ͨ����ʯ������2.20g����������D������Ϊ________ g��ExH2O�Ļ�ѧʽΪ________��
����Ŀ�������ʾΪ��Ȼ���еĶ���ͭ��ʯ����Ҫ�ɷ֣�
��ʯ���� | ��ͭ�� | ��ͭ�� | ��ͭ�� | ��ȸʯ |
��Ҫ�ɷ� | CuFeS2 | Cu5FeS4 | Cu2S | CuCO3Cu��OH��2 |
��ش�
��1���ϱ�����ͭ�������У�ͭ�������ٷֺ�����ߵ������ѧʽ��
��2����ҵ���Ի�ͭ��Ϊԭ�ϣ����û�������������ͭ���ù��յ��м���̰�����Ӧ�� 2Cu2O+Cu2S ![]() 6Cu+SO2������÷�Ӧ���������뻹ԭ�������ʵ���֮����
6Cu+SO2������÷�Ӧ���������뻹ԭ�������ʵ���֮����
��3����������������ͭ��β��ֱ���ŷŵ���������ɻ�����Ⱦ�ĺ������������β���ɵõ��м�ֵ�Ļ�ѧƷ��д������һ�����һ���ε����ƻ�ѧʽ�� ��
��4���±��У��Գ��������ȷ�Լ������������ϵ���ж϶���ȷ����������ĸ����
ѡ�� | ������ | ������ | �ж� |
A | ͭ�̵����ɷ��Ǽ�ʽ����ͭ | ����ϡ�����ͭ�������ͭ�� | ��ԣ���ԣ��� |
B | ͭ�����γ����ܵ�����Ĥ | ͭ��������ʢ��Ũ���� | ��ԣ���ԣ��� |
C | ����ͭ���� | í��ͭ���ϵ������ڳ�ʪ�����в������� | ��ԣ���ԣ��� |
D | ��ɫ����ͭ��������ת��Ϊ��ɫ����ͭ��ĩ�������仯 | ����ͭ��Һ��������Ӿ�ص������� | �������ԣ��� |