题目内容
【题目】【2017届山东省德州市陵城一中高三12月月考化学试卷】纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
①2Cu(s)+1/2O2(g)===Cu2O(s) ΔH=-169 kJ·mol-1,
②C(s)+1/2O2===CO(g) ΔH=-110.5 kJ·mol-1,
③2Cu(s)+ O2(g)===2CuO(s) ΔH=-314 kJ·mol-1
(1)则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为______________________。
(2)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。
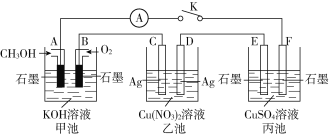
请回答下列问题:
①甲池为__________(填“原电池”“电解池”或 “电镀池”),A电极的电极反应式为______________
②丙池中电池总反应的离子方程式:_______________________
③当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为______mL(标准状况)。
④一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是________(填选项字母)。
A.CuO B. Cu C.Cu(OH)2 D.Cu2(OH)2CO3
【答案】C(S)+2Cu2O(s)=Cu2O(S)+CO(g) +34.5KJ/mol
原电池 CH3OH-6e-+8OH-=CO32-+6H2O
2Cu2++2H20==2Cu+O2+4H+ 560 A
【解析】
试题解析:(1)根据盖斯定律:对三个热化学反应方程式的处理消去氧气,得出C(S) + 2Cu2O(s) = Cu2O(S) + CO(g);ΔH=+34.5KJ/mol;(2)甲为甲醇的燃料电池,为原电池;甲醇为负极发生氧化反应,极反应CH3OH-6e-+8OH-=CO32-+6H2O;②丙池为电解硫酸铜溶液,阴极铜离子得电子变为铜,阳极为氢氧根离子失电子变为氧气,总反应的离子方程式2Cu2++2H20==2Cu+O2+4H+;③乙池中阳极银溶解,,Ag-e=Ag; 当乙池中C极质量减轻10.8 g时,消耗银0.1摩尔,转移电子0.1摩尔;甲池中B电极为氧气得电子发生还原反应:O2+4e+2H2O=4OH- 根据串联电路电流强度相等规律:消耗氧气体积为1/4×0.1×22.4×103=560Ml; ④ 电解硫酸铜溶液,析出铜,放出氧气,要恢复到原状态,需要加入CuO;加入铜,少氧,质量不够;加入C.Cu(OH)2 D.Cu2(OH)2CO3引入水,所得溶液浓度变小;

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】原电池是化学对人类的一项重大贡献。
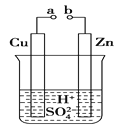
(1)某兴趣小组为研究原电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是 ________________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),该电极反应式是____________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了1mol电子, 则理论上Zn片质量减轻________g。
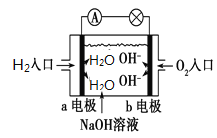
(2)如图是氢氧燃料电池原理示意图B,回答下列问题:电池的正极是________(填“a”或“b”)电极,该极的电极反应式为: _________________________。