题目内容
10.某学生欲配制6.0mol/L的H2SO4溶液980mL,实验室有三种不同浓度的硫酸:①480mL 0.5mol/L的硫酸;②150mL 25%的硫酸(ρ=1.18g/mL);③足量的18mol/L的硫酸.老师要求把①②两种硫酸全部用完,不足的部分由③来补充.请回答下列问题:(1)实验所用25%的硫酸的物质的量浓度为3.0mol/L(保留1位小数).
(2)该实验需要使用到的玻璃仪器有:量筒、烧杯、玻璃棒、1000mL容量瓶、胶头滴管.
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整.
A.将①②两溶液全部倒入烧杯中混合均匀;
B.用量筒准确量取所需的18mol/L的浓硫酸,沿烧杯内壁倒入上述混合液中,并用玻璃棒搅拌,使其混合均匀;
C.将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中;
D.用蒸馏水洗涤烧杯和玻璃棒2-3次,并将洗涤液一并转移至容量瓶中;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1~2cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧、振荡、摇匀.
(4)如果省略操作D,对所配置溶液浓度有何影响?偏小(偏大、偏小,无影响?)
(5)进行操作C前还需注意混合液需冷却至室温再转移至容量瓶中.
分析 (1)依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;
(2)配制980mL溶液,需要选择1000mL容量瓶;结合配制一定物质的量溶液的步骤选择需要的仪器;
(3)移液后的操作为洗涤,依据洗涤方法解答;
(4)省略洗涤操作,导致溶质部分损耗,溶质的物质的量偏小,依据C=$\frac{n}{V}$进行误差分析;
(5)依据容量瓶使用注意问题解答.
解答 解:(1)25%的硫酸(ρ=1.18g/mL)的物质的量浓度C=$\frac{1000×1.18×25%}{98}$=3.0mol/L,故答案为:3.0;
(2)配制980mL溶液,需要选择1000mL容量瓶;用浓溶液配制稀溶液,一般步骤:计算、量取、稀释、移液、洗涤、定容,用到的仪器:量筒、烧杯、玻璃棒、1000mL容量瓶;胶头滴管;所以还需要的仪器:1000mL容量瓶;胶头滴管;
故答案为:1000mL容量瓶;胶头滴管;
(3)移液后的操作为洗涤,正确的操作方法为:用蒸馏水洗涤烧杯和玻璃棒2-3次,并将洗涤液一并转移至容量瓶中;
故答案为:用蒸馏水洗涤烧杯和玻璃棒2-3次,并将洗涤液一并转移至容量瓶中;
(4)省略洗涤操作,导致溶质部分损耗,溶质的物质的量偏小,依据C═$\frac{n}{V}$,溶液浓度偏小;
故答案为:偏小;
(5)容量瓶为精密仪器,不能盛放过热、过冷的液体,只有在室温下,体积才准确;
所以进行操作C前还需注意:混合液需冷却至室温再转移至容量瓶中;
故答案为:混合液需冷却至室温再转移至容量瓶中.
点评 本题考查溶液浓度的计算和一定物质的量浓度溶液的配制,明确配制步骤和容量瓶的使用方法是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
1.按下列实验方法操作,能达到要求的是( )
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 苹果含有Fe2+,现榨苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入具有还原性的维生素C,可防止该现象发生 | |
| C. | 用NaOH溶液和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
15.某烃1mol最多能和2mol HCl加成,生成氯代烃,此氯代烃l mol能和4mol Cl2发生完全取代反应,此烃为( )
| A. | C2H2 | B. | C2H4 | C. | C3H4 | D. | C6H6 |
19. 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
( )
 下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)
下列各组物质依次满足如图所示转化关系的是(图中箭头表示一步转化)| a | b | c | d | |
| ① | Si | SiO2 | H2SiO3 | Na2SiO3 |
| ② | N2 | NO | NO2 | HNO3 |
| ③ | Cu | CuO | Cu(OH)2 | CuSO4 |
| ④ | Na | NaOH | Na2CO3 | NaHCO3 |
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
20.可逆反应:A(g)+2B(g)═2C(g)△H=-Q kJ/mol.现有甲、乙两个容积相等且不变的密闭容器,向甲容器中充入1mol A和2mol B,在一定条件下达到平衡时放出的热量为Q1 kJ;在相同条件下向乙容器中充入2mol C,达到平衡后吸收的热量为Q2 kJ.已知Q1=9Q2,下列叙述中正确的是( )
| A. | Q1=Q | B. | 平衡时甲中C的体积分数比乙中小 | ||
| C. | 达到平衡时,甲中A的转化率为90% | D. | Q1+Q2>Q |
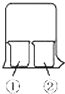 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白: