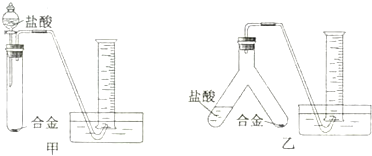
题目内容
12.已知:①N2(g)+2O2(g)=2NO2(g)△H1=+67.7KJ/mol②N2H4(g)+O2(g)=N2(g)+2H2O(g)△H2=-534KJ/mol
计算2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)的反应热△H3.
分析 ①N2(g)+2O2(g)═2NO2(g)△H1=+67.7KJ/mol;
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534KJ/mol;
依据盖斯定律②×2-①计算得到.
解答 解:①N2(g)+2O2(g)═2NO2(g)△H1=+67.7KJ/mol;
②N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=-534KJ/mol;
依据盖斯定律②×2-①得到,则肼与NO2完全反应的热化学方程式为:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1135.7KJ/mol
答:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)的反应热△H3=-1135.7KJ/mol.
点评 本题考查了热化学方程式的书写方法和盖斯定律的计算应用,题目较简单.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
2.可逆反应aA(g)+bB(s)?cC(g)+dD(g),其他条件不变,C的物质的量分数和温度(T)或压强(P)关系如图,其中正确的是( )
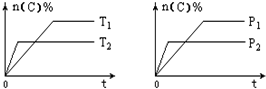

| A. | T1>T2 | B. | 化学方程式系数a>c+d | ||
| C. | 升高温度,平衡向逆反应方向移动 | D. | 使用催化剂,C的物质的量分数增加 |
3.胶体区别于溶液的最本质特征是( )
| A. | 可以通过滤纸 | B. | 胶体有丁达尔效应 | ||
| C. | 胶体粒子带有电荷 | D. | 胶体粒子的直径在1~100 nm之间 |
17.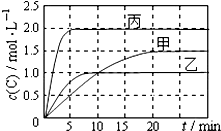 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)═2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示.下列说不正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)═2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示.下列说不正确的是( )
 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)═2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示.下列说不正确的是( )
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:A(g)+xB(g)═2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别以下图和下表表示.下列说不正确的是( ) | 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5L | 0.5L | 1.0L |
| 温度/℃ | T1 | T2 | T2 |
| 反应物 起始量 | 1.5molA 0.5molB | 1.5molA 0.5molB | 6.0molA 2.0molB |
| A. | 10min内乙容器中反应的平均速率:v(A)=0.05mol•(L•min)-1 | |
| B. | 由图可知T1>T2,且该反应为吸热反应 | |
| C. | x=1,若平衡时保持温度不变,改变容器体积平衡不移动 | |
| D. | T2℃,丙容器比乙容器反应快的原因可能是使用了催化剂 |
1.按下列实验方法操作,能达到要求的是( )
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 苹果含有Fe2+,现榨苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入具有还原性的维生素C,可防止该现象发生 | |
| C. | 用NaOH溶液和FeCl3溶液制备Fe(OH)3胶体 | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |