��Ŀ����
����Ŀ��
Ŀǰ��������ѧ�ҽ�������ͭ��CuSe�������Ŵ����������һ������ӵ�أ�ʹ�������С�����ܸ�ǿ�ش��������⣺
��l����̬Seԭ�ӵļ۵����Ų�ʽΪ___________����̬Cuԭ�����̬Seԭ�Ӻ���δ�ɶԵ�����֮��Ϊ_______��
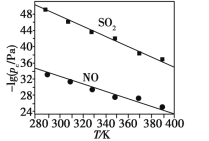
��2��SeO2���ܽ���ˮ���۵�340��350�棬315��ʱ�������ɴ˿��ж�SeO2�еĻ�ѧ������Ϊ__________��
��3��Se2C12Ϊ���غ�ɫ�ľ綾Һ�壬����ӽṹ�к���Se-Se�����÷����У�Seԭ�ӵ��ӻ��������Ϊ________, Se2C12�Ŀռ乹��Ϊ________������ĸ����
a��ֱ���� b������� c������ d����������
��4������ͭ��CuSeO4���ڵ��ӡ��DZ���ҵ�з�����Ҫ���á���������������Ƚϣ����Խ�ǿ����___________���ѧʽ��, Cu��Se��O��һ�������ɴ�С��˳����_________��
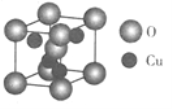
��5��Cu��O�γɵ�һ�ֻ�����ľ�����ͼ��ʾ���û�����Ļ�ѧʽΪ______���������IJ���Ϊa cm�����ܶ�Ϊ________���ú�a ��NA�Ĵ���ʽ��ʾ����
���𰸡� 4s244p4 1:2 ���ۼ� sp3 b H2SO4 O>Se>Cu Cu2O ![]()
����������l��Se��ԭ��������34����̬Seԭ�ӵļ۵����Ų�ʽΪ4s24p4����̬Cuԭ�����̬Seԭ�Ӻ���δ�ɶԵ�����֮��Ϊ1:2����2��SeO2���ܽ���ˮ���۵�340��350����315��ʱ�������ɴ˿��ж�SeO2�Ƿ��Ӿ��壬���еĻ�ѧ������Ϊ���ۼ�����3��Se2C12Ϊ���غ�ɫ�ľ綾Һ�壬����ӽṹ�к���Se-Se��������8�����ȶ��ṹ��֪���ʯΪCl��Se��Se��Cl����˸÷����У�Seԭ�ӵ��ӻ��������Ϊsp3��Se�ļ۲���Ӷ�����4������2�Թ¶Ե��ӣ�Se2C12�Ŀռ乹��Ϊ����Σ���ѡb����4��ͬ������ϵ��·ǽ�������С����ۺ��������������������������������Ƚϣ����Խ�ǿ����H2SO4���ǽ�����Խǿ����һ������Խ����Cu��Se��O��һ�������ɴ�С��˳����O>Se>Cu����5�����ݾ����ṹ��֪Cuԭ�Ӹ�����1+8��1/8=2����ԭ��ȫ���ھ����У�����4�����û�����Ļ�ѧʽΪ Cu2O���������IJ���Ϊa cm���������a3cm3�����ܶ�![]() g/cm3��
g/cm3��

 ���ݼ���ϵ�д�
���ݼ���ϵ�д�����Ŀ�����г���I��II����ȷ�����������ϵ���ǣ� ��
ѡ�� | ����I | ����II |
A | Fe2O3�Ǻ���ɫ��ĩ | Fe2O3������ɫͿ�� |
B | SiO2������������ | SiO2�ɺ�HF��Ӧ |
C | Al2O3������ˮ | Al2O3�������ͻ���� |
D | SO2��Ư���� | SO2��ʹ��ˮ��ɫ |
A. A B. B C. C D. D