题目内容
化学反应速率的变化和化学平衡移动的规律都可以通过实验得出结论,勒夏特列原理也是由实验总结出来的。
(1)将铜片投入到稀硝酸中,开始时产生气泡的速率很慢,随后反 应速率增大,根据你学到的知识分析,反应速率增大的原因是________________ __________________。当进行一段时间后,反应速率又减慢,这次速率减慢的原因是_______________________________。
应速率增大,根据你学到的知识分析,反应速率增大的原因是________________ __________________。当进行一段时间后,反应速率又减慢,这次速率减慢的原因是_______________________________。
(2)丙酮和碘在酸性溶液中发生下列反应:CH3COCH3+I2 CH3COCH2I+H++I-。25℃时,该反应的速率由下列经验公式决定:
CH3COCH2I+H++I-。25℃时,该反应的速率由下列经验公式决定:
υ=k?c(CH3COCH3)?c(H+)[mol/(L?s)]
根据该经验公式,如果c(I2),c(CH3COCH3),c(H+)的起始浓度依次为0.01 mol/L,0.1 mol/L,0.01 mol/L,分析反应速率的变化趋势是_______________ ________________。
(3)在一支试管中先加入30 mL 0.01 mol/L FeCl3溶液,再滴加10 mL 0.01 mol/L KSCN溶液,摇匀。将制得的溶液平均分装于4支试管中,然后分别加入:①FeCl3固体;②KSCN固体;③KCl固体;④H2O。充分振荡后,溶液的颜色基本不变的是________(填序号)。
(4)在50 mL的注射器中吸入40 mL NO2和N2O4的混合气体,在另一同样规格的注射器中吸入40 mL Br2(g),对比两注射器中气体的颜色完全一致。然后都将注射器的活塞慢慢推至20 mL处,发现注射器内气体的颜色变化的现象是___________________________。推测平衡移动是通过观察装入NO2和N2O4的混合气体的注射器内气体的颜色比装入Br2(g)的注射器内气体的颜色_______。
(5)如果要鉴别密封于由两球连通的密闭容器中充满的红棕色气体是NO2和N2O4混合气还是Br2(g),可以____________________。
(1)将铜片投入到稀硝酸中,开始时产生气泡的速率很慢,随后反
 应速率增大,根据你学到的知识分析,反应速率增大的原因是________________ __________________。当进行一段时间后,反应速率又减慢,这次速率减慢的原因是_______________________________。
应速率增大,根据你学到的知识分析,反应速率增大的原因是________________ __________________。当进行一段时间后,反应速率又减慢,这次速率减慢的原因是_______________________________。(2)丙酮和碘在酸性溶液中发生下列反应:CH3COCH3+I2
 CH3COCH2I+H++I-。25℃时,该反应的速率由下列经验公式决定:
CH3COCH2I+H++I-。25℃时,该反应的速率由下列经验公式决定:υ=k?c(CH3COCH3)?c(H+)[mol/(L?s)]
根据该经验公式,如果c(I2),c(CH3COCH3),c(H+)的起始浓度依次为0.01 mol/L,0.1 mol/L,0.01 mol/L,分析反应速率的变化趋势是_______________ ________________。
(3)在一支试管中先加入30 mL 0.01 mol/L FeCl3溶液,再滴加10 mL 0.01 mol/L KSCN溶液,摇匀。将制得的溶液平均分装于4支试管中,然后分别加入:①FeCl3固体;②KSCN固体;③KCl固体;④H2O。充分振荡后,溶液的颜色基本不变的是________(填序号)。
(4)在50 mL的注射器中吸入40 mL NO2和N2O4的混合气体,在另一同样规格的注射器中吸入40 mL Br2(g),对比两注射器中气体的颜色完全一致。然后都将注射器的活塞慢慢推至20 mL处,发现注射器内气体的颜色变化的现象是___________________________。推测平衡移动是通过观察装入NO2和N2O4的混合气体的注射器内气体的颜色比装入Br2(g)的注射器内气体的颜色_______。
(5)如果要鉴别密封于由两球连通的密闭容器中充满的红棕色气体是NO2和N2O4混合气还是Br2(g),可以____________________。
(1)该反应是放热反应(1分)。随着反应的进行,硝酸的浓度减小(1分)。
(2)先逐渐增大后逐渐减小 (2分)。
(3)③ (2分)。
(4)前者先变深后变浅,但比原来深;后者只变深 (2分)。 浅 (2分)。
(5)通过加热(其他合理答案也可) (2分)。
(2)先逐渐增大后逐渐减小 (2分)。
(3)③ (2分)。
(4)前者先变深后变浅,但比原来深;后者只变深 (2分)。 浅 (2分)。
(5)通过加热(其他合理答案也可) (2分)。
略

练习册系列答案
相关题目
 B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol?L-1) 随反应时间 (min) 的变化情况如下表:
B(g) + D(g) 在4种不同条件下进行,B和D的起始浓度为0 ,反应物A 的浓度(mol?L-1) 随反应时间 (min) 的变化情况如下表: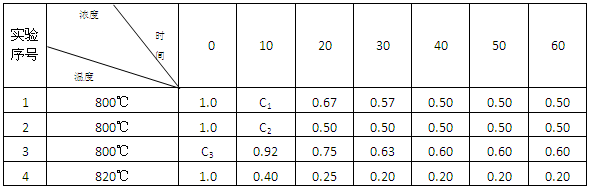
 2SO3,反应开始时,反应速率由大到小排列顺序正确的是( )
2SO3,反应开始时,反应速率由大到小排列顺序正确的是( )
 2NH3(g) (正反应放热),工业合成氨采用在500℃的条件下进行的原因是
2NH3(g) (正反应放热),工业合成氨采用在500℃的条件下进行的原因是 H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是
H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是  ,某化学研究小组的同学分别设计了如图甲、乙、丙所示的实验。请回答相关问题:
,某化学研究小组的同学分别设计了如图甲、乙、丙所示的实验。请回答相关问题:

 最快的是:
最快的是: