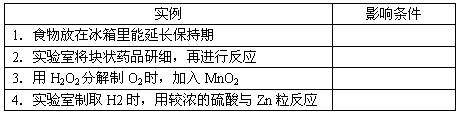
题目内容
25℃时,向V mL pH=a的盐酸中,滴加p H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是
H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是
 H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是
H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是 | A.13 | B.14 | C.15 | D.不能确定 |
A
略

练习册系列答案
相关题目
 2CO2(g)+N2(g) △H<0。
2CO2(g)+N2(g) △H<0。

 T/K
T/K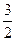 O2(g) ΔH
O2(g) ΔH =+765.2kJ·mol-1
=+765.2kJ·mol-1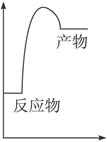
 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH2的物质的量与反应体系中总的物质的量之比)为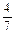 。计算
。计算 。
。 形状相同
形状相同 条件相同。
条件相同。
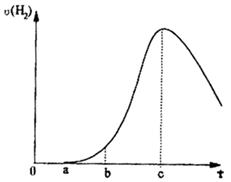
 应速率增大,根据你学到的知识分析,反应速率增大的原因是________________ __________________。当进行一段时间后,反应速率又减慢,这次速率减慢的原因是_______________________________。
应速率增大,根据你学到的知识分析,反应速率增大的原因是________________ __________________。当进行一段时间后,反应速率又减慢,这次速率减慢的原因是_______________________________。 CH3COCH2I+H++I-。25℃时,该反应的速率由下列经验公式决定:
CH3COCH2I+H++I-。25℃时,该反应的速率由下列经验公式决定: