题目内容
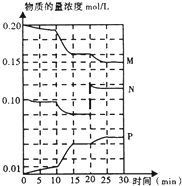 如图所示是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )
如图所示是某反应体系中的三种气态物质M、N、P的物质的量浓度随时间的变化情况,则下列判断不正确的是( )| A、该反应的化学方程式可表达为2M+N?2P | B、当反应时间为20 min时,曲线开始发生变化的原因可能是由于增大压强引起的 | C、反应在10 min时,若曲线的变化是由于升温造成的(其他条件不变),则该反应的正反应一定为吸热反应 | D、在反应时间段10 min~15 min内,物质P的反应速率约为0.0001 mol/(L?s) |
分析:A、利用物质的量浓度变化值之比等于化学计量数之比求出化学方程式;
B、当反应时间为20min时,N浓度增大,M、P浓度没变,据此判断;
C、反应在10min达到化学平衡状态,若曲线的变化是由于升温造成的,根据平衡移动判断△H;
D、在反应时间为10min-15min之内,物质P的浓度变化为0.03mol/L,再根据v=
计算.
B、当反应时间为20min时,N浓度增大,M、P浓度没变,据此判断;
C、反应在10min达到化学平衡状态,若曲线的变化是由于升温造成的,根据平衡移动判断△H;
D、在反应时间为10min-15min之内,物质P的浓度变化为0.03mol/L,再根据v=
| △C |
| t |
解答:解:A、根据图象可知M、N浓度减小为反应物,P浓度增大为生成物,在0~15min时,M的浓度变化值为:0.2-0.16=0.04mol/L,N的浓度变化值为:0.1-0.08=0.02mol/L,P的浓度变化值为:0.04mol/L,根据物质的量浓度变化值之比等于化学计量数之比,则化学计量数之比为:0.04:0.02:0.04=2:1:2,所以该反应的化学方程式可表达为2M+N?2P,故A正确;
B、当反应时间为20min时,N浓度增大,M、P浓度没变,所以曲线开始发生变化的原因是增大了N的浓度,故B错误;
C、反应在10min达到化学平衡状态,若曲线的变化是由于升温造成的,而M、N的浓度减小,P的浓度增大,说明升高温度平衡正移,正反应为吸热反应,故C正确;
D、在反应时间为10min-15min之内,物质P的浓度变化为0.01mol/L,v=
=
=0.006mol/(L?min),故D错误;
故选:BD.
B、当反应时间为20min时,N浓度增大,M、P浓度没变,所以曲线开始发生变化的原因是增大了N的浓度,故B错误;
C、反应在10min达到化学平衡状态,若曲线的变化是由于升温造成的,而M、N的浓度减小,P的浓度增大,说明升高温度平衡正移,正反应为吸热反应,故C正确;
D、在反应时间为10min-15min之内,物质P的浓度变化为0.01mol/L,v=
| △c |
| t |
| (0.04-0.01)mol/L |
| 5min |
故选:BD.
点评:本题考查物质的量浓度随时间变化曲线、化学平衡的影响因素,速率的计算等,难度中等,注意根据图象中的变化分析解答.

练习册系列答案
相关题目
在一定体积的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
(1)该反应的化学平衡常数表达式为K= .
(2)该反应为 反应(选填“吸热”、“放热”).
(3)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K 1.0(选填“大于”、“小于”、“等于”)
(4)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2mol?L-1、2mol?L-1、4mol?L-1、4mol?L-1,则此时上述反应的平衡移动方向为 .(选填“正反应方向”、“逆反应方向”、“不移动”)
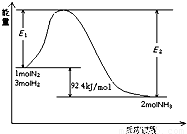
(5)科学家一直致力于“人工固氮”的方法研究.目前合成氨的技术原理为:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
该反应的能量变化如图所示.
①在反应体系中加入催化剂,反应速率增大,E2的变化是: .(填“增大”、“减小”或“不变”).
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g)?2NH3(g)
5分钟后达到平衡,测得N2为0.2mol,H2为0.6mol,NH3为0.2mol.氮气的平均反应速率v(N2)= ,H2的转化率是 .
③欲提高②容器中H2的转化率,下列措施一定可行的是 .
A.增大压强
B.改变反应的催化剂
C.液化生成物分离出氨
D.向容器中按原比例再充入原料气
E.升高温度.
CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)该反应为 反应(选填“吸热”、“放热”).
(3)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K 1.0(选填“大于”、“小于”、“等于”)
(4)若1200℃时,在某时刻该容器中CO2、H2、CO、H2O的浓度分别为2mol?L-1、2mol?L-1、4mol?L-1、4mol?L-1,则此时上述反应的平衡移动方向为 .(选填“正反应方向”、“逆反应方向”、“不移动”)
(5)科学家一直致力于“人工固氮”的方法研究.目前合成氨的技术原理为:
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
该反应的能量变化如图所示.
①在反应体系中加入催化剂,反应速率增大,E2的变化是: .(填“增大”、“减小”或“不变”).
②将一定量的N2(g)和H2(g)放入2L的密闭容器中,在500℃、2×107Pa下发生如下反应:N2(g)+3H2(g)?2NH3(g)
5分钟后达到平衡,测得N2为0.2mol,H2为0.6mol,NH3为0.2mol.氮气的平均反应速率v(N2)= ,H2的转化率是 .
③欲提高②容器中H2的转化率,下列措施一定可行的是 .
A.增大压强
B.改变反应的催化剂
C.液化生成物分离出氨
D.向容器中按原比例再充入原料气
E.升高温度.

 在一定体积的密闭容器中,进行如下化学反应:
在一定体积的密闭容器中,进行如下化学反应: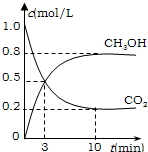 为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.