题目内容
【题目】已知25 ℃时有关弱酸的电离平衡常数如下表:
弱电解质化学式 | CH3COOH | HCN | H2CO3 | NH3.H2O |
电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.4×10-7 K2=4.7×10-11 | 1.8×10-5 |
下列推断正确的是( )
A. 25℃时,同浓度的下列溶液 pH 关系为:pH(NaHCO3)>pH(NaCN)>pH(CH3COONa)
B. 若25℃时某溶液中c(CO32-)=c(HCO3-),则此溶液中 c(H+)=4.7×10-11 mol·L-1
C. 若25℃时某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入少量盐酸后, c(CO32-)>c(HCO3-)
D. 25℃时等浓度的NaCN和NH4Cl溶液,前者的阴离子浓度之和大于后者的阳离子浓度之和
【答案】B
【解析】A、 25℃时,酸性CH3COOH>H2CO3>HCN>HCO3-,同浓度的下列溶液 pH 关系为:pH(Na2CO3)>pH(NaCN)>pH(NaHCO3)>pH(CH3COONa),故A错误;B、c(CO32-)=c(HCO3-),K2=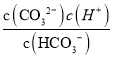 =c(H+)=4.7×10-11 mol·L-1,故B正确;C、若25℃时某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入少量盐酸后,CO32-+H+= HCO3-,c(CO32-)<c(HCO3-),故C正确;D、25℃时等浓度的NaCN和NH4Cl溶液,电荷守恒分别为c(Na+)+c(H+ )=c(CN― )+c(OH― )、c(NH4+ )+c(H+ )=c(OH― )+c(Cl― ),CN― 的水解能力强,得到的OH― 多,c(OH― )+c(Cl― )>c(Na+)+c(H+ ),前者的阴离子浓度之和小于后者的阳离子浓度之和,故D错误;故选B。
=c(H+)=4.7×10-11 mol·L-1,故B正确;C、若25℃时某溶液中c(CO32-)=c(HCO3-),往该溶液中滴入少量盐酸后,CO32-+H+= HCO3-,c(CO32-)<c(HCO3-),故C正确;D、25℃时等浓度的NaCN和NH4Cl溶液,电荷守恒分别为c(Na+)+c(H+ )=c(CN― )+c(OH― )、c(NH4+ )+c(H+ )=c(OH― )+c(Cl― ),CN― 的水解能力强,得到的OH― 多,c(OH― )+c(Cl― )>c(Na+)+c(H+ ),前者的阴离子浓度之和小于后者的阳离子浓度之和,故D错误;故选B。

 名校课堂系列答案
名校课堂系列答案