题目内容
室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的盐酸,直至盐酸过量.(1)在滴加过程中,水的电离程度的变化是先______后______(填“增大”、“减小”或“不变”);
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和溶液的pH.
试填写表中空白:
| 离子浓度的关系 | 溶质的化学式 | 溶液的pH | |
| ① | [NH4+]>[Cl-]>[OH-]>[H+] | ______ | pH>7 |
| ② | [NH4+]=[Cl-] | NH4Cl、NH3?H2O | ______ |
| ③ | ______ | NH4Cl | pH<7 |
| ④ | [Cl-]>[H+]>[NH4+>[OH-] | ______ | pH<7 |
【答案】分析:(1)含有弱根离子的盐能促进水的电离,酸溶液或碱溶液能抑制水的电离.
(2)根据溶液中离子浓度的大小顺序、对应溶质、溶液的pH之间的关系进行判断.
解答:解:(1)含有弱根离子的盐能促进水的电离,酸溶液或碱溶液能抑制水的电离,所以在滴加过程中,碱溶液逐渐变成含有弱根离子的盐溶液,当盐酸过量时,盐溶液又逐渐变成酸溶液,所以水的电离程度的变化是先增大后减小.
故答案为:增大;减小.
(2)①当混合溶液的pH>7时,氨水过量,则溶液中的溶质是氯化铵和氨水.
故答案为:NH4Cl、NH3?H2O.
②当溶液中氯离子浓度等于铵根离子浓度时,根据溶液呈电中性知,溶液中氢氧根离子浓度等于氢离子浓度,溶液呈中性.
故答案为:pH=7.
③当混合溶液中溶质为NH4Cl,铵根离子水解导致铵根离子浓度小于氯离子浓度,水解后溶液呈酸性,溶液中氢离子浓度大于氢氧根离子浓度,但水解是微弱的,所以铵根离子浓度大于氢离子浓度.
故答案为:[Cl-]>[NH4+]>[H+]>[OH-].
④当混合溶液中[Cl-]>[H+]>[NH4-]>[OH-]时,则混合溶液中的溶质是NH4Cl、HCl.
故答案为:NH4Cl、HCl.
点评:本题考查了混合溶液中离子浓度大小的比较、溶液中水电离程度的变化等知识点,根据溶液中的溶质来分析判断即可,难度不大.
(2)根据溶液中离子浓度的大小顺序、对应溶质、溶液的pH之间的关系进行判断.
解答:解:(1)含有弱根离子的盐能促进水的电离,酸溶液或碱溶液能抑制水的电离,所以在滴加过程中,碱溶液逐渐变成含有弱根离子的盐溶液,当盐酸过量时,盐溶液又逐渐变成酸溶液,所以水的电离程度的变化是先增大后减小.
故答案为:增大;减小.
(2)①当混合溶液的pH>7时,氨水过量,则溶液中的溶质是氯化铵和氨水.
故答案为:NH4Cl、NH3?H2O.
②当溶液中氯离子浓度等于铵根离子浓度时,根据溶液呈电中性知,溶液中氢氧根离子浓度等于氢离子浓度,溶液呈中性.
故答案为:pH=7.
③当混合溶液中溶质为NH4Cl,铵根离子水解导致铵根离子浓度小于氯离子浓度,水解后溶液呈酸性,溶液中氢离子浓度大于氢氧根离子浓度,但水解是微弱的,所以铵根离子浓度大于氢离子浓度.
故答案为:[Cl-]>[NH4+]>[H+]>[OH-].
④当混合溶液中[Cl-]>[H+]>[NH4-]>[OH-]时,则混合溶液中的溶质是NH4Cl、HCl.
故答案为:NH4Cl、HCl.
点评:本题考查了混合溶液中离子浓度大小的比较、溶液中水电离程度的变化等知识点,根据溶液中的溶质来分析判断即可,难度不大.

练习册系列答案
相关题目
在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。请回答下列问题。
(1)在实验过程中水的电离程度的变化趋势是先____________后____________(填“增大”“减小”或“不变”)。
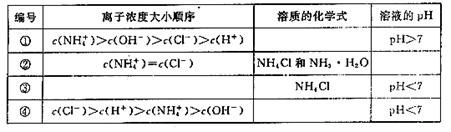
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH,请将表中空格部分填上相应的内容,将表格补充完整。
编号 | 离子浓度大小顺序 | 溶质的化学式 | 溶液的pH |
① | c( |
| pH>7 |
② | c( | NH4Cl和NH3·H2O |
|
③ |
| NH4Cl | pH<7 |
④ | c(Cl-)>c(H+)>c( |
| pH<7 |
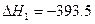 kJ·mol-1
kJ·mol-1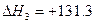 kJ·mol-1
kJ·mol-1 。
。 CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率( )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。