题目内容
在室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的稀盐酸,直至盐酸过量。请回答下列问题。(1)在实验过程中水的电离程度的变化趋势是先____________后____________(填“增大”“减小”或“不变”)。
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序、对应溶质的化学式和溶液的pH,请将表中空格部分填上相应的内容,将表格补充完整。
编号 | 离子浓度大小顺序 | 溶质的化学式 | 溶液的pH |
① | c( |
| pH>7 |
② | c( | NH4Cl和NH3·H2O |
|
③ |
| NH4Cl | pH<7 |
④ | c(Cl-)>c(H+)>c( |
| pH<7 |
(1)增大 减小
(2)①NH3·H2O和NH4Cl ②pH=7 ③c(Cl-)>c(![]() )>c(H+)>c(OH-) ④HCl和NH4Cl
)>c(H+)>c(OH-) ④HCl和NH4Cl
解析:(1)酸和碱都抑制水的电离,弱盐则促进水的电离。开始时属于碱的氨水的消耗和属于弱盐的NH4Cl的生成都使水的电离程度增大,后来属于酸的盐酸过量,导致水的电离程度又减小。(2)由①中c(OH-)>c(H+)可知氨水没有反应完全,溶质为NH3·H2O和NH4Cl。②中据溶液呈电中性列出的等式为c(H+)+c(![]() )=c(OH-)+c(Cl-),由c(
)=c(OH-)+c(Cl-),由c(![]() )=c(Cl-)得c(H+)=c(OH-),相应pH=7。③中
)=c(Cl-)得c(H+)=c(OH-),相应pH=7。③中![]() 因部分水解而减少,NH4Cl溶液中离子浓度相对大小关系为c(Cl-)>c(
因部分水解而减少,NH4Cl溶液中离子浓度相对大小关系为c(Cl-)>c(![]() )>c(H+)>c(OH-)。④中c(H+)>c(
)>c(H+)>c(OH-)。④中c(H+)>c(![]() ),可知HCl已过量,则溶质为HCl和NH4Cl。
),可知HCl已过量,则溶质为HCl和NH4Cl。

练习册系列答案
相关题目
室温下,向一定量的稀氨水中逐滴加入物质的量浓度相同的盐酸,直至盐酸过量.
(1)在滴加过程中,水的电离程度的变化是先______后______(填“增大”、“减小”或“不变”);
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和溶液的pH.
试填写表中空白:
(1)在滴加过程中,水的电离程度的变化是先______后______(填“增大”、“减小”或“不变”);
(2)在下表中,分别讨论了上述实验过程中离子浓度的大小顺序,对应溶质的化学式和溶液的pH.
试填写表中空白:
| 离子浓度的关系 | 溶质的化学式 | 溶液的pH | |
| ① | [NH4+]>[Cl-]>[OH-]>[H+] | ______ | pH>7 |
| ② | [NH4+]=[Cl-] | NH4Cl、NH3?H2O | ______ |
| ③ | ______ | NH4Cl | pH<7 |
| ④ | [Cl-]>[H+]>[NH4+>[OH-] | ______ | pH<7 |
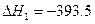 kJ·mol-1
kJ·mol-1 kJ·mol-1
kJ·mol-1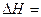 。
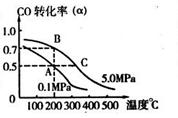
。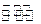 CH3OH(g);CO的转化率(
CH3OH(g);CO的转化率( )与温度、压强的关系如右图所示。
)与温度、压强的关系如右图所示。