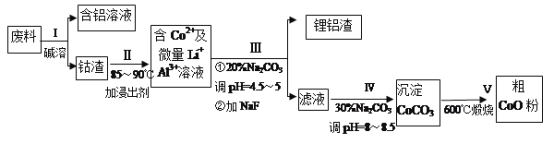
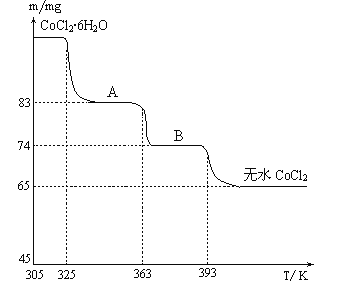
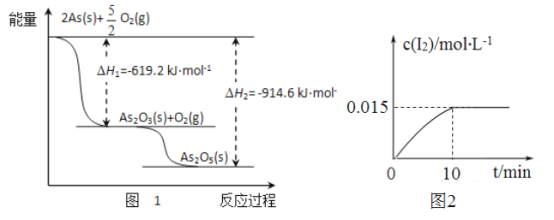
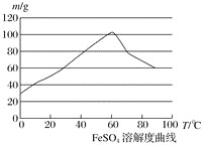
题目内容
【题目】油脂的不饱和度可通过油脂与碘的加成反应测定,通常称为油脂的碘值。碘值越大,油脂的不饱和程度越高。碘值是指100g油脂所能吸收的I2的克数。
I.称取xg某油脂,加入含ymol I2的韦氏溶液( 韦氏溶液是碘值测定时使用的特殊试剂,含有CH3COOH),充分振荡;过量的I2用c mol/LNa2S2O3标准溶液滴定(淀粉作指示剂),消耗Na2S2O3溶液VmL(滴定反应为:2 Na2S2O3+ I2=Na2S4O6+2NaI)。回答下列问题:
(1)有关滴定的下列说法正确的是________(填标号)。
A.标准Na2S2O3溶液应盛装在碱式滴定管中
B.滴定时眼睛只要注视滴定管中溶液体积的变化
C.滴定到溶液由无色变蓝色时应该立即停止滴定
D.同样的滴定应重复2-3次,取几次滴定所用溶液的平均值计算滴定结果
(2)该油脂的碘值为___g(列式表示)。
(3)用该测定方法测定的碘值需要用相关的实验校正,因为所测得的碘值总比实际碘值低,原因是_____________________________________________。
II.现要从上述测定碘值实验后的含碘废液中回收碘单质(废液中含有H2O、油脂、I2、I-)。设计如图一所示的实验过程:

(4)为了将含碘废液中的I2完全转化为I-而进入水层,向含碘度液中加入了稍过量的A溶液,则A应该具有___________性。
(5)将操作①所得溶液放入图二所示的三颈烧瓶中,并用盐酸调至pH约为2,再缓慢通入适量Cl2,使其在30~40℃反应。反应要控制在30~40℃的原因是________________;Cl2不能过量,因为过量的Cl2将I2氧化为IO3-,写出该反应的离子方程式___________________________。

(6)操作②包含多步操作,将在三颈烧瓶中反应完全后的溶液经过操作②获得碘单质,在操作②中必须用列下列所示的部分仪器或装置,这些仪器和装置是________________(填标号)。

【答案】 AD (25400y-12.7cV)/x或[(y-1/2cV×10-3)/x]×25400或(25400y-12700cV×10-3)/x 韦氏液中的CH3COOH消耗Na2S2O3,使滴定过程消耗的Na2S2O3偏大,导致测出的与油脂反应的I2偏少 还原 温度太低反应太慢、温度过高氯气溶解度变小,碘易挥发 5Cl2+I2+6H2O=10C1-+2IO3-+12H+ ①⑤
【解析】试题分析:(1)根据滴定操作的要求分析;(2)根据油脂、Na2S2O3溶液共消耗ymol I2计算油脂的碘值;(3)CH3COOH与Na2S2O3反应,消耗Na2S2O3;(4)I2完全转化为I-,发生还原反应;(5)根据反应速率、碘的挥发性分析;Cl2与I2反应生成盐酸和碘酸;(6)反应完全后的溶液经过萃取、分液、蒸馏获得碘单质;
解析:(1) A.标准Na2S2O3溶液呈碱性,应盛装在碱式滴定管中,故A正确; B.滴定时眼睛只要注视锥形瓶内溶液颜色的变化,故B错误; C.滴定前锥形瓶内溶液呈蓝色,滴定到溶液由蓝色变为无色时,并且半分钟内不变色,达到滴定终点,故C错误; D.为减小误差,滴定应重复2-3次,取几次滴定所用溶液的平均值计算滴定结果,故D正确。(2) 根据2 Na2S2O3+ I2=Na2S4O6+2NaI,Na2S2O3溶液消耗碘的物质的量是![]() ,设 xg某油脂碘的质量为ag,
,设 xg某油脂碘的质量为ag, ![]() ,a=
,a=![]() , 该油脂的碘值为(25400y-12.7cV)/x;(3). 韦氏液中的CH3COOH消耗Na2S2O3,使滴定过程消耗的Na2S2O3偏大,导致测出的与油脂反应的I2偏少;(4)I2完全转化为I-,发生还原反应,所以A具有还原性;(5). 温度太低反应太慢、温度过高氯气溶解度变小,碘易挥发,所以温度控制在30~40℃;Cl2与I2反应生成盐酸和碘酸,反应离子方程式是5Cl2+I2+6H2O=10C1-+2IO3-+12H+;(6)反应完全后的溶液经过萃取、分液、蒸馏获得碘单质,需要的仪器有分液漏斗、蒸馏装置,蒸馏装置中温度计液泡在支管口、用直形冷凝管,故选①⑤;
, 该油脂的碘值为(25400y-12.7cV)/x;(3). 韦氏液中的CH3COOH消耗Na2S2O3,使滴定过程消耗的Na2S2O3偏大,导致测出的与油脂反应的I2偏少;(4)I2完全转化为I-,发生还原反应,所以A具有还原性;(5). 温度太低反应太慢、温度过高氯气溶解度变小,碘易挥发,所以温度控制在30~40℃;Cl2与I2反应生成盐酸和碘酸,反应离子方程式是5Cl2+I2+6H2O=10C1-+2IO3-+12H+;(6)反应完全后的溶液经过萃取、分液、蒸馏获得碘单质,需要的仪器有分液漏斗、蒸馏装置,蒸馏装置中温度计液泡在支管口、用直形冷凝管,故选①⑤;

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案