题目内容
【题目】含有较多Ca2+、Mg2+和HC![]() O3-的水称为暂时硬水,加热可除去Ca2+、Mg2+ , 使水变为软水.现有一锅炉厂使用这种水,试判断其水垢的主要成分为( ) (已知Ksp(MgCO3)=6.8×10﹣6 , Ksp[Mg(OH)2]=5.6×10﹣12)
O3-的水称为暂时硬水,加热可除去Ca2+、Mg2+ , 使水变为软水.现有一锅炉厂使用这种水,试判断其水垢的主要成分为( ) (已知Ksp(MgCO3)=6.8×10﹣6 , Ksp[Mg(OH)2]=5.6×10﹣12)
A.CaO、MgO
B.CaCO3、MgCO3
C.CaCO3、Mg(OH)2
D.CaCO3、MgO
【答案】C
【解析】解:暂时硬水中存在Ca(HCO3)2和Mg(HCO3)2,Ca(HCO3)2受热时分别分解成CaCO3,因Mg(OH)2溶度积较小,则加热时水解,HCO3﹣水解,生成溶度积较小的Mg(OH)2,则水垢的主要成分为CaCO3、Mg(OH)2,
故选C.

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案【题目】某酸性工业废水中含有K2Cr2O7 . 光照下,草酸(H2C2O4)能将其中的Cr2O72﹣转化为Cr3+ . 某课题组研究发现,少量铁明矾[Al2Fe(SO4)424H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成以下实验设计表
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | 60 | 10 | 30 |
② | 5 | 60 | 10 | 30 |
③ | 5 | 60 |
测得实验①和②溶液中的Cr2O72﹣浓度随时间变化关系如图所示.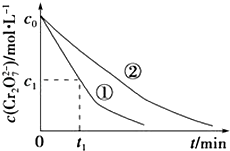
(2)上述反应后草酸被氧化的离子方程式为
(3)实验①和②的结果表明;实验①中0~t1时间段反应速率v(Cr3+)=molL﹣1min﹣1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)424H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三: 假设一:Fe2+起催化作用:
假设二:;
假设三:;
(5)请你设计实验验证上述假设一,完成下表中内容. (除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4Al2(SO4)324H2O、Al2(SO4)3等.溶液中Cr2O72﹣的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |



