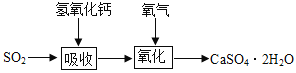
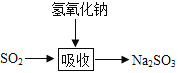
题目内容
【题目】原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、0族元素除外)( )

A. 4x B. 4x+6 C. 4x+10 D. 4x+14
【答案】B
【解析】如果D与E、E与D相差原子序数相同时,四种元素的原子序数之和为4x;如果E是第三周期第IIIA族到第VIIA族元素,D和E原子序数相差18,B和E原子序数相差8;如果E是第四周期Ca元素,D和E原子序数相差8,B和E原子序数相差18;如果E是第四周期第IIIA族到第VIIA族元素,D和E原子序数相差18、B和E原子序数相差18;如果这几种元素都是副族元素,且E是第五周期第IVB族到第VIII族、第IB族时,B和E原子序数相差18、E和D原子序数相差32,据此进行解答。
如果D与E、E与D相差原子序数相同时,则A、B、C、D四种元素的原子序数之和为4x;如果E为第三周期第IIIA族到第VIIA族元素,D和E原子序数相差18,B和E原子序数相差8,则A、B、C、D四种元素的原子序数之和为4x+10;如果E是第四周期Ca元素,B和E原子序数相差8,D和E原子序数相差18,则A、B、C、D四种元素的原子序数之和为4x+10;如果E是第四周期第IIIA族到第VIIA族元素,D和E原子序数相差18、B和E原子序数相差18,A、B、C、D四种元素的原子序数之和为4x;如果这几种元素都是副族元素,且E是第五周期第IVB族到第VIII族、第IB族时,B和E原子序数相差18、E和D原子序数相差32,则A、B、C、D四种元素的原子序数之和为4x+14,通过以上分析知,A、B、C、D四种元素原子序数之和不可能为4x+6,答案选B。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目