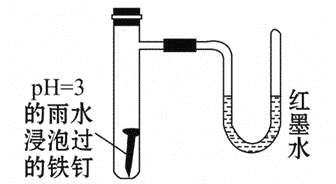
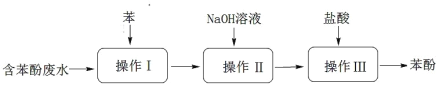
题目内容
【题目】某小组同学以不同方案探究Cu粉与FeCl3溶液的反应。
(1)甲同学向FeCl3溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,由此证明发生了反应,其离子方程式是______________________________________________。
(2)乙同学通过反应物的消耗证明了上述反应的发生:将Cu粉加入到滴有少量KSCN的FeCl3溶液中,观察到溶液红色褪去,有白色沉淀A产生。
① 针对白色沉淀A,查阅资料:A可能为CuCl和CuSCN(其中硫元素的化合价为-2价)中的一种或两种。实验过程如下:

请回答:
Ⅰ. 根据白色沉淀B是__________________(填化学式),判断沉淀A中一定存在CuSCN。
Ⅱ. 仅根据白色沉淀A与过量浓HNO3反应产生的实验现象,不能判断白色沉淀A中一定存在CuSCN,从氧化还原角度说明理由:_______________________________________________________。
Ⅲ. 向滤液中加入a溶液后无明显现象,说明A不含CuCl,则a是________________(填化学式)。
根据以上实验,证明A仅为CuSCN。
② 进一步查阅资料并实验验证了CuSCN的成因,将该反应的方程式补充完整:
_______Cu2+ + _______SCN![]() = _______CuSCN↓ + _______ (SCN)2
= _______CuSCN↓ + _______ (SCN)2
③ 结合上述过程以及Fe(SCN)3 Fe3+ + 3SCN![]() 的平衡,分析(2)中溶液红色褪去的原因:_________________。
的平衡,分析(2)中溶液红色褪去的原因:_________________。
(3)已知(SCN)2称为拟卤素,其氧化性与Br2相近。将KSCN溶液滴入(1)所得的溶液中,观察到溶液变红色,则溶液变红的可能原因是_______________________________________________。
【答案】Cu + 2Fe3+ = Cu2+ + 2Fe2+ BaSO4 +1价铜也可将浓HNO3还原 AgNO3 2Cu2+ + 4SCN- = 2CuSCN↓ + (SCN)2 Cu和Fe3+反应生成Cu2+使c(Fe3+)减小 ![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 使
使![]() 减小,Cu2+和SCN-反应生成CuSCN沉淀使c(SCN-)减小,均使该平衡正向移动,导致Fe(SCN)3浓度减小,溶液红色褪去 Fe3+有剩余 空气中的O2将Fe2+氧化 (SCN)2将Fe2+氧化
减小,Cu2+和SCN-反应生成CuSCN沉淀使c(SCN-)减小,均使该平衡正向移动,导致Fe(SCN)3浓度减小,溶液红色褪去 Fe3+有剩余 空气中的O2将Fe2+氧化 (SCN)2将Fe2+氧化
【解析】
(1)向![]() 溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,说明生成了铜离子;
溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,说明生成了铜离子;
(2)①Ⅰ.根据流程图沉淀B不溶于酸,故该沉淀是硫酸钡;
Ⅱ. ![]() 中铜元素显+1价,也具有还原性,能够还原硝酸;
中铜元素显+1价,也具有还原性,能够还原硝酸;
Ⅲ.用硝酸银溶液检验滤液中是否含有氯离子即可;
②根据氧化还原规律和元素守恒配平;
③![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 使
使![]() 减小,
减小,![]() 和
和![]() 反应生成
反应生成![]() 沉淀使
沉淀使![]() 减小;
减小;
(3)溶液变红色,说明溶液中含有![]() 。
。
(1)向![]() 溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,说明生成了铜离子,离子方程式为:
溶液中加入Cu粉,观察到溶液的颜色变为浅蓝色,说明生成了铜离子,离子方程式为:![]() ,
,
故答案为:![]() ;
;
(2)①Ⅰ.根据流程图,溶液中含有过量的硝酸,即沉淀B不溶于酸,故该沉淀是硫酸钡,
答案为:![]() ;
;
Ⅱ. ![]() 中铜元素显+1价,也具有还原性,能够还原硝酸,故仅根据白色沉淀A与过量浓
中铜元素显+1价,也具有还原性,能够还原硝酸,故仅根据白色沉淀A与过量浓![]() 反应产生的实验现象,不能判断白色沉淀A中一定存在
反应产生的实验现象,不能判断白色沉淀A中一定存在![]() ,
,
答案为:+1价铜也可将浓![]() 还原;
还原;
Ⅲ.若白色沉淀A中含有![]() ,则滤液中含有氯离子,故用硝酸银溶液检验滤液中是否含有氯离子即可,
,则滤液中含有氯离子,故用硝酸银溶液检验滤液中是否含有氯离子即可,
答案为:![]() ;
;
②根据氧化还原规律,一个![]() 转移1个电子,生成一个
转移1个电子,生成一个![]() 转移2个电子,故
转移2个电子,故![]() 和
和![]() 的系数比为2:1,根据元素守恒配平即可,
的系数比为2:1,根据元素守恒配平即可,
答案为:![]() ;
;
③![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 使
使![]() 减小,
减小,![]() 和
和![]() 反应生成
反应生成![]() 沉淀使
沉淀使![]() 减小,均使
减小,均使![]() 正向移动,导致
正向移动,导致![]() 浓度减小,溶液红色褪去,
浓度减小,溶液红色褪去,
故答案为:![]() 和
和![]() 反应生成
反应生成![]() 和
和![]() 使
使![]() 减小,
减小,![]() 和
和![]() 反应生成
反应生成![]() 沉淀使
沉淀使![]() 减小,均使该平衡正向移动,导致
减小,均使该平衡正向移动,导致![]() 浓度减小,溶液红色褪去;
浓度减小,溶液红色褪去;
(3)将![]() 溶液滴入(1)所得的溶液中,观察到溶液变红色,说明溶液中含有
溶液滴入(1)所得的溶液中,观察到溶液变红色,说明溶液中含有![]() ,
,![]() 有可能是反应剩余的,或空气中的氧气将
有可能是反应剩余的,或空气中的氧气将![]() 氧化生成的,根据题意
氧化生成的,根据题意![]() 也有氧化性,故也有可能是
也有氧化性,故也有可能是![]() 将
将![]() 氧化为
氧化为![]() ,
,
故答案为:![]() 有剩余;空气中的
有剩余;空气中的![]() 将
将![]() 氧化;
氧化;![]() 将
将![]() 氧化。
氧化。

【题目】CO2与CH4可制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+247 kJ·mol-1。初始温度均为T K时,在3个容器中按不同方式投入反应物,发生上述反应,相关信息如下表:
容器 | 起始物质的量/mol | CO2平衡转化率(α) | |||||
编号 | 容积/L | 条件 | CH4(g) | CO2(g) | CO(g) | H2(g) | |
Ⅰ | 2 | 恒温恒容 | 2 | 1 | 0 | 0 | 50% |
Ⅱ | 1 | 0.5 | 1 | 0 | 0 | ||
Ⅲ | 1 | 绝热恒容 | 1 | 0.5 | 0 | 0 | - |
下列说法正确的是
A.T K时,反应CH4(g)+CO2(g)2CO(g)+2H2(g)的平衡常数为1/3
B.容器Ⅱ中反应达到平衡时,α(CO2,Ⅱ)=50%
C.容器Ⅲ中反应达到平衡时反应热在123.5—247 kJ·mol-1范围内
D.容器Ⅱ中反应达到平衡时,再投入0.5 mol CH4、0.25 mol CO,反应达到新平衡前,v(正)<v(逆)