题目内容
【题目】过氧化钠常作漂白剂、杀菌剂、消毒剂。过氧化钠保存不当容易吸收空气中CO2而变质。
(1)某课外活动小组欲探究某过氧化钠样品是否已经变质,取少量样品,溶解,加入___溶液,充分振荡后有白色沉淀,证明Na2O2已经变质。
(2)该课外活动小组为了粗略测定过氧化钠的纯度,他们称取ag样品,并设计用如图装置来测定过氧化钠的质量分数。
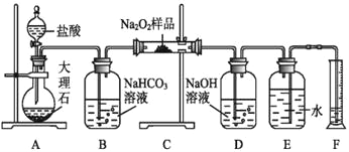
①A中发生反应离子方程式为 ____________________________________ 。
②将仪器连接好以后,必须进行的第一步操作是___________________________。
③B装置出来的气体是否需要干燥____(填“是”或“否”)。
④D中NaOH溶液的作用_______________________
⑤读出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,则样品中过氧化钠的质量分数为 _______________
⑥实验完成后E到F之间导管内残留水的体积会使测量结果________(填“偏大”“偏小”或“不影响”)。
【答案】CaCl2或BaCl2溶液 CaCO3+2H+===Ca2++H2O+CO2↑ 检查装置的气密性 否 吸收未反应的CO2 39V/56a% 偏小
【解析】
(1)过氧化钠在空气中变质会最后生成碳酸钠固体,依据碳酸根离子检验是否变质;
(2)装置图中A为生成二氧化碳的装置,B为洗气装置,C为二氧化碳与过氧化钠反应的装置,D为吸收多余的二氧化碳的装置,E和F是测量生成氧气的体积的装置,据此分析解答。
(1)过氧化钠在空气中变质会最后生成碳酸钠固体,探究一包过氧化钠样品是否已经变质,可以利用碳酸根离子和钡离子或钙离子结合生成碳酸钡或碳酸钙白色沉淀证明Na2O2已经变质,取少量样品,溶解,加入CaCl2或BaCl2溶液,充分振荡后有白色沉淀,证明Na2O2已经变质;
(2)①A中发生反应是碳酸钙和盐酸反应生成二氧化碳、水和氯化钙,反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑;
②实验探究测定方法是测定二氧化碳和过氧化钠反应生成的氧气,装置中必须是气密性完好,将仪器连接好以后,必须进行的第一步操作是检查装置的气密性;
③B装置出来的气体不需要干燥,因为二氧化碳、水蒸气和过氧化钠反应均生成氧气,反应的化学方程式为:2CO2+2Na2O2=2Na2CO3+O2,2Na2O2+2H2O=4NaOH+O2↑,过氧化钠反应生成氧气的物质的量定量关系相同对测定过氧化钠质量分数无影响,所以不需要干燥除去水蒸气;
④装置C中是二氧化碳、水蒸气和过氧化钠反应生成氧气的反应,反应中二氧化碳是过量的,则D为吸收多余的二氧化碳的装置,防止多余的二氧化碳进入量气装置,导致测得的氧气的体积偏大;
⑤测定出量筒内水的体积后,折算成标准状况下氧气的体积为VmL,物质的量为![]() ,则样品中过氧化钠的物质的量是
,则样品中过氧化钠的物质的量是![]() ,质量是
,质量是![]() ,所以质量分数为
,所以质量分数为![]() ;
;
⑥实验完成后E到F之间导管内残留水的体积会使测定氧气体积减小,导致测定过氧化钠质量分数测量结果偏小。