题目内容
已知25 ℃时,下列酸的电离常数:醋酸:1.75×10-5氢氰酸:4.93×10-10
氢氟酸:7.2×10-4甲酸:1.77×10-4则物质的量浓度均为0.1 mol·L-1的上述溶液酸性最强的是 ( )
A 醋酸 B 氢氰酸 C氢氟酸 D甲酸
C
解析正确答案:C
浓度相同时,组成相似的酸,电离常数越大,酸性越强,氢氟酸:7.2×10-4,酸性最强。

练习册系列答案
相关题目
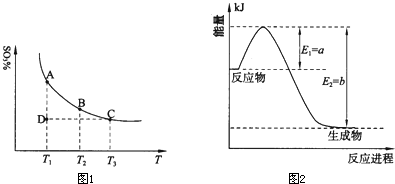
 2SO2(g)
2SO2(g) +O2(g)
+O2(g) 2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g),混合体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: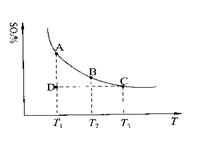
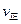
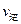 (填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(填“>”、“<”或“=”)(2)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。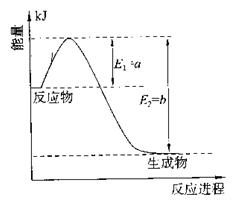
 色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
色沉淀生成,向反应后的浊液中,继续加入0.1mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。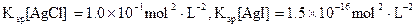 )
)