题目内容
【题目】下列盐的水溶液呈酸性的是( )
A.NaClB.Na2CO3C.CH3COONaD.AlCl3
【答案】D
【解析】
A. NaCl为强酸强碱盐,在水溶液中不发生水解,c(OH-)=c(H+),溶液呈中性,A错误;
B. Na2CO3为强碱弱酸盐,CO32-发生水解结合水电离出来的H+,溶液中c(OH-)>c(H+),溶液呈碱性,B错误;
C. CH3COONa为强碱弱酸盐,CH3COO-发生水解结合水电离出来的H+,溶液中c(OH-)>c(H+),溶液呈碱性,C错误;
D. AlCl3为强酸弱碱盐,Al3+发生水解结合水电离出来的OH-,溶液中c(OH-)<c(H+),溶液呈酸性,D正确;
答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】一定温度下,在三个体积均为2.0L的恒容密闭容器中分别加入一定量的X,发生反应:pX(g) ![]() Y(g)+Z(g),相关数据如下表所示:
Y(g)+Z(g),相关数据如下表所示:
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
X(g) | Y(g) | Z(g) | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | 0.160 | 0.160 |
Ⅲ | T | 0.20 | 0.090 | 0.090 |
回答下列问题:
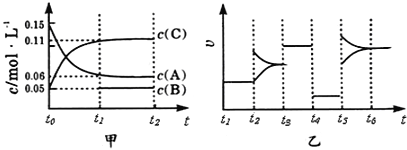
(1)若容器Ⅰ中反应经10min达到平衡,则前10min内Y的平均反应速率v(Y)=___________。容器Ⅰ和容器Ⅱ中起始时X的反应速率v(X)Ⅰ___________v(X)Ⅱ(填“大于”“小于”或“等于”)。
(2)已知该正反应为放热反应,则T___________387(填“大于”或“小于”),判断理由是___________。
(3)反应方程式中X的化学计量数p的取值为___________,容器Ⅱ中X的平衡转化率为___________。若起始时向容器Ⅰ中充入0.1molX、0.15molY和0.10molZ,则反应将向___________ (填“正”或“逆”)反应方向进行,判断理由是_____________________________________________________。
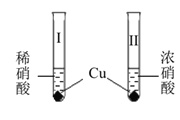
【题目】室温下,某兴趣小组用下图装置在通风橱中进行如下实验:
实验 | 现象 |
| 试管中开始无现象,逐渐有微小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色. |
试管中剧烈反应,迅速生成大量红棕色气体, 溶液呈绿色;之后向绿色溶液中持续通入N2, 溶液变为蓝色. |
下列说法正确的是
A. 试管Ⅰ中浅红棕色气体为NO2,由硝酸还原生成
B. 等质量的 Cu 完全溶解时,Ⅰ中消耗的HNO3更多
C. 换成Fe之后重复实验,依然是试管Ⅱ中反应更剧烈
D. 试管Ⅱ中反应后溶液颜色与试管Ⅰ中的不同,是由于溶有NO2