题目内容
【题目】碲(Te)位于元素周期表第ⅥA族,该元素组成的物质可用作石油裂化的催化剂、电镀液的光亮剂、玻璃的着色材料及合金材料的添加剂等。精炼铜的阳极混含有Cu2Te、Au、Ag等,利用下列工艺流程可回收碲:
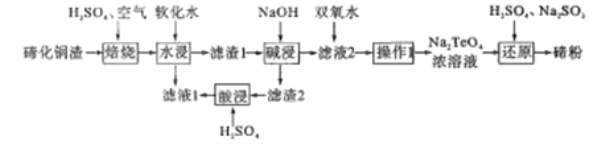
已知:TeO2熔点733℃,微溶于水,可溶于强酸和强碱。回答下列问题:
(1)Te与S的简单氢化物的稳定性强弱顺序为:__________(用氢化物的化学式表示)。
(2)“焙烧”的化学方程式__________(碲主要以TeO2形式存在)。
(3)“焙烧”后的固体用软化水“水浸”,该过程的有效物质的浸出率及浸出速率对该工艺流程很重要,写出两条提高“水浸”速率的措施:________。“滤液1”的溶质有________。
(4)“滤渣1”进行“碱浸”的目的是________
(5)“滤液2”加入双氧水,能否改用氯水或氯气,说明原因:_________
(6)“还原”制备碲粉的氧化产物是_________
(7)从环境保护和资源合理开发的可持续发展意识和绿色化学观念来看,分析“滤渣2”进行“酸浸”的意义:________
【答案】 H2S>H2Te Cu2Te+2H2SO4+2O2![]() 2CuSO4+TeO2+2H2O 固体粉碎、适当提高水的温度 CuSO4、H2SO4 制备TeO32-(或溶解TeO2) 不能,Na2TeO4中含NaCl杂质,且氯水或氯气有毒 Na2SO4 “酸浸”的滤液中含CuSO4,滤渣中的Au、Ag均能进行回收。符合绿色化学的现点
2CuSO4+TeO2+2H2O 固体粉碎、适当提高水的温度 CuSO4、H2SO4 制备TeO32-(或溶解TeO2) 不能,Na2TeO4中含NaCl杂质,且氯水或氯气有毒 Na2SO4 “酸浸”的滤液中含CuSO4,滤渣中的Au、Ag均能进行回收。符合绿色化学的现点
【解析】(1)同主族元素从上到下氢化物稳定性逐渐减弱,Te与S的简单氢化物的稳定性强弱顺序为H2S>H2Te ;(2)Cu2Te氧化成CuSO4和TeO2,“焙烧”的化学方程式Cu2Te+2H2SO4+2O2![]() 2CuSO4+TeO2+2H2O;(3)“焙烧”后的固体用软化水“水浸”,该过程的有效物质的浸出率及浸出速率对该工艺流程很重要,写出两条提高“水浸”速率的措施:固体粉碎、适当提高水的温度。“滤液1”的溶质有CuSO4、H2SO4;(4)TeO2是酸性氧化物,与碱反应生成盐和水,“滤渣1”进行“碱浸”的目的是制备TeO32-(或溶解TeO2);(5)“滤液2”加入双氧水,不能改用氯水或氯气,原因:Na2TeO4中含NaCl杂质,且氯水或氯气有毒;(6)用Na2SO3“还原”制备碲粉的氧化产物是Na2SO4;(7)从环境保护和资源合理开发的可持续发展意识和绿色化学观念来看,“滤渣2”进行“酸浸”的意义:“酸浸”的滤液中含CuSO4,滤渣中的Au、Ag均能进行回收。符合绿色化学的现点。
2CuSO4+TeO2+2H2O;(3)“焙烧”后的固体用软化水“水浸”,该过程的有效物质的浸出率及浸出速率对该工艺流程很重要,写出两条提高“水浸”速率的措施:固体粉碎、适当提高水的温度。“滤液1”的溶质有CuSO4、H2SO4;(4)TeO2是酸性氧化物,与碱反应生成盐和水,“滤渣1”进行“碱浸”的目的是制备TeO32-(或溶解TeO2);(5)“滤液2”加入双氧水,不能改用氯水或氯气,原因:Na2TeO4中含NaCl杂质,且氯水或氯气有毒;(6)用Na2SO3“还原”制备碲粉的氧化产物是Na2SO4;(7)从环境保护和资源合理开发的可持续发展意识和绿色化学观念来看,“滤渣2”进行“酸浸”的意义:“酸浸”的滤液中含CuSO4,滤渣中的Au、Ag均能进行回收。符合绿色化学的现点。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案