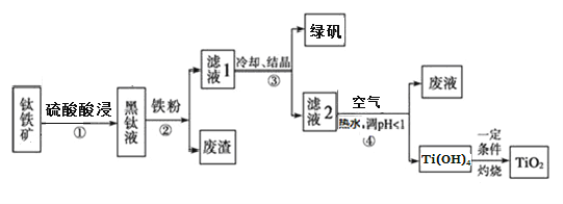
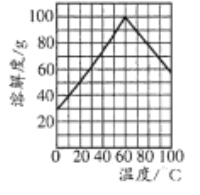
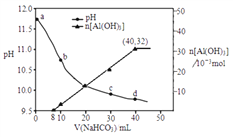
题目内容
【题目】25℃时,重水(D2O)的离子积为1.6×10-15,也可用pH值一样的定义来规定其酸碱度:pD=-lg[D+],下列有关pD的叙述正确的是( )
①中性D2O的pD=7
②在1LD2O中,溶解0.01molNaOD,其pD值为12
③1L0.01mol/L的DCl的重水溶液,pD=2
④在100mL0.25mol/LDCl的重水溶液中,加入50mL0.2mol/LNaOD的重水溶液,反应后溶液的pD=1.
A. ①②B. ③④C. ②③D. ②④
【答案】B
【解析】
①25℃时,重水(D2O)的离子积为1.6×10-15,中性纯水中,C(D+)=C(OD-)=![]() mol/L=4×10-8mol/L,PD=-lg[D+]=8-lg4>7,故①错误;②在1LD2O中,溶解0.01molNaOD,NaOD的物质的量浓度小于0.01mol/L,所以C(OD-)<0.01mol/L,C(D+)>1.6×10-13,则PD值>12,故②错误;③1L0.01mol/L的DCl的重水溶液,C(D+)>=0.01mol/L,PD=2,故③正确; ④在100mL0.25mol/LDCl的重水溶液中,n(DCl)=0.25mol/L×0.1L=0.025mol,50mL0.2mol/LNaOD的重水溶液中,C(NaOD)=0.2mol/L×0.05L=0.01mol<n(DCl),则酸过量,混合溶液中C(DCl)=
mol/L=4×10-8mol/L,PD=-lg[D+]=8-lg4>7,故①错误;②在1LD2O中,溶解0.01molNaOD,NaOD的物质的量浓度小于0.01mol/L,所以C(OD-)<0.01mol/L,C(D+)>1.6×10-13,则PD值>12,故②错误;③1L0.01mol/L的DCl的重水溶液,C(D+)>=0.01mol/L,PD=2,故③正确; ④在100mL0.25mol/LDCl的重水溶液中,n(DCl)=0.25mol/L×0.1L=0.025mol,50mL0.2mol/LNaOD的重水溶液中,C(NaOD)=0.2mol/L×0.05L=0.01mol<n(DCl),则酸过量,混合溶液中C(DCl)=![]() =0.1mol/L,则C(D+)>=0.1mol/L,PD=1,故④正确;③④正确,故答案为B。
=0.1mol/L,则C(D+)>=0.1mol/L,PD=1,故④正确;③④正确,故答案为B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】下列实验中的颜色变化,与氧化还原反应无关的是
选项 | A | B | C | D |
实验 | NaOH溶液滴入FeSO4溶液中 | 石蕊溶液滴入氯水中 | KSCN溶液滴入FeCl3溶液中 | CO2通过装有Na2O2固体的干燥管 |
现象 | 产生白色沉淀,随后变为红褐色 | 溶液变红,随后迅速褪色 | 溶液变为红色 | 固体由淡黄色变为白色 |
A. A B. B C. C D. D