��Ŀ����
�о�NO2����CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
���÷�Ӧ6NO2(g)��8NH3(g) 7N2(g)��12 H2O(g)�ɴ���NO2��700��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������NO2��NH3, ��Ӧ�����вⶨ�IJ������ݼ��±�
7N2(g)��12 H2O(g)�ɴ���NO2��700��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������NO2��NH3, ��Ӧ�����вⶨ�IJ������ݼ��±�
| ��Ӧʱ��/min | n(NO2)/mol | n(NH3)/ mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.90 | |
| 4 | | 0.40 |
4min�÷�Ӧ�ﵽƽ��״̬����÷�Ӧ��ƽ�ⳣ��K�ı���ʽΪ ��NO2��ת����Ϊ
��2�� 700�� ����NO2��NH3�������1:2�����ܱ������з���������Ӧ��������˵����Ӧ�ﵽƽ��״̬���� ��
a����ϵѹǿ���ֲ��� b�����������ɫ���ֲ���
c����ϵ�ܶȱ��ֲ��� d��ÿ����1 mol NO2��ͬʱ����2 mol H2O
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO��g��+2H2��g��
 CH3OH��g����200��ʱ������һ�����������ܱ�����������г���һ������CO��H2����������Ӧ,ѹ���������ݻ�Ϊԭ����һ�룬ƽ�⽫ �ƶ������������ң�������CO��Ũ�Ƚ� ������С�����䣩
CH3OH��g����200��ʱ������һ�����������ܱ�����������г���һ������CO��H2����������Ӧ,ѹ���������ݻ�Ϊԭ����һ�룬ƽ�⽫ �ƶ������������ң�������CO��Ũ�Ƚ� ������С�����䣩
��1�� 0.1mol/(L��min) K={C7(N2)��C12(H2O)}/{C6(NO2)��C8(NH3)} 75�G
��2��a b ��3������ ����
���������������1���ɿ�ʼ��2����ʱ��n(NO2)=0.3mol,��n(NH3)=(8/6)��0.4mol.V(NH3)= {��n(NH3)/V}/��t=(0.4mol/2L)��2min=0.1mol/(L��min).��ѧƽ�ⳣ���ǿ��ܷ�Ӧ�ﵽ��ѧƽ��ʱ��������Ũ����ָ���ij˻������Ӧ��Ũ����ָ���˻��ıȡ���K={C7(N2)��C12(H2O)}/{C6(NO2)��C8(NH3)}����Ӧ���е� 4minʱ���÷�Ӧ�ﵽƽ��״̬����ʱ��n(NH3)=1.60-0.4=1.20��mol������n(NO2)=6/8��n(NH3)="(" 6/8)��1.20mol=0.9mol.����NO2��ת����Ϊ��(0.9mol/1.2mol)��100�G=75�G.
��2��a���ڸ÷�Ӧ�Ǹ���Ӧǰ������������ȵĿ��淴Ӧ�����Ե���Ӧ�ﵽ��ѧƽ��ʱ��ϵ��ѹǿ���䡣��ȷ��bƽ��ʱ��Ӧ������Ũ�ȱ��ֲ��䡣��ΪNO2�Ǻ���ɫ���壬���Դﵽƽ��ʱ���������ɫ���ֲ��䡣��ȷ��c���ڷ�Ӧ���������غ㶨�ɡ���ϵ���ݻ����䡣���������Ƿ�Ӧ��Ҳ�����Ƿ�Ӧ�Ƿ�ﵽƽ�⡣��ϵ���ܶȶ����ᷢ���ı䡣����D�κ�ʱ��ÿ����1 mol NO2��ͬʱ����2 mol H2O�����Ƿ�Ӧ������Ӧ������С��뷴Ӧ�Ƿ�ﵽƽ���ء���������ѡ��Ϊ��a b.��3������Ӧ�ﵽ��ѧƽ��ʱѹ�������������ѹǿ����ѧƽ�������������С�ķ����ƶ���Ҳ����������Ӧ�����ƶ�����ʱ��Ӧ������Ũ�ȶ�����
���㣺���黯ѧ��Ӧ���ʵļ��㡢��ѧƽ�ⳣ������������Ի�ѧƽ���Ӱ��ȵ�֪ʶ��

 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�һ���¶��£���2L�ܱ�������NO2��O2�ɷ������з�Ӧ�� 4NO2(g)+O2(g)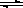 2N2O5(g)+5286 kJ��֪��ϵ��n(NO2)��ʱ��仯���±���
2N2O5(g)+5286 kJ��֪��ϵ��n(NO2)��ʱ��仯���±���
| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
��1����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
A��v��NO2��=4v��O2�� B��������ѹǿ���ֲ���
C��v����N2O5��=2v����O2�� D���������ܶȱ��ֲ���
��2����Ӧ�ﵽƽ���NO2��ת����Ϊ ���� ʱ����ͨ��һ������������NO2��ת���ʽ� (���������С���������䡱)��
��3��ͼ���ܱ�ʾN2O5��Ũ�ȱ仯�������� ����O2��ʾ��0~500s�ڸ÷�Ӧ��ƽ������v= ��
��4����ʹ�÷�Ӧ�ķ�Ӧ����������ƽ������Ӧ�����ƶ����� ��
A����ʱ�����NO2���� B���ʵ������¶�
C������O2��Ũ�� D��ѡ���Ч����
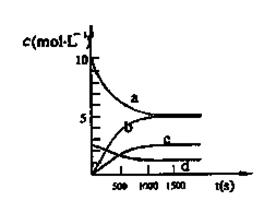
ijС������H2C2O4��Һ������KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족��ʵ��ʱ���ȷֱ���ȡ������Һ��Ȼ�����Թ���Ѹ����Ͼ��ȣ���ʼ��ʱ��ͨ���ⶨ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������С����������·�����
| ʵ���� | H2C2O4��Һ | ����KMnO4��Һ | �¶� | ||
| Ũ��(mol·L��1) | ���(mL) | Ũ��(mol·L��1) | ��� (mL) | ||
| �� | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| �� | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| �� | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
��1����֪��Ӧ��H2C2O4ת��ΪCO2�ݳ���KMnO4ת��ΪMnSO4��ÿ����1molH2C2O4ת��_______mol���ӡ�Ϊ�˹۲쵽��ɫ��ȥ��H2C2O4��KMnO4��ʼ�����ʵ�����Ҫ����Ĺ�ϵΪn(H2C2O4)��n(KMnO4)��______��
��2��̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________(���ţ���ͬ)����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________��
��3��ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ40s�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v(KMnO4)��________mol·L��1·min��1��
��4����֪ʵ�����c(MnO4-)����Ӧʱ��t�ı仯��������ͼ�������������������䣬����ͼ�л���ʵ�����c(MnO4-)��t�ı仯����ʾ��ͼ��
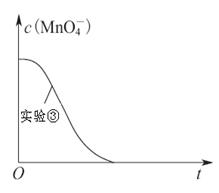
��7�֣��ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɶ����ѵ����ȼ�ϣ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У�
��CH4��g��+H2O��g��?CO��g��+3H2��g����H1=+206��1kJ/mol
��CH4��g��+CO2��g��?2CO��g��+2H2��g����H2=+247��3kJ/mol
��CO��g��+H2O��g��?CO2��g��+H2��g����H3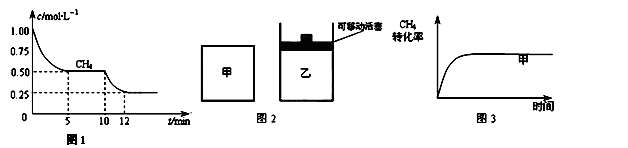
��ش��������⣺
��1����һ�����ܱ������н��з�Ӧ�٣����CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ����Ӧ���е�ǰ5min�ڣ� ��H2��= ��10minʱ���ı��������������� ��
��H2��= ��10minʱ���ı��������������� ��
��2����ͼ2��ʾ���ڼס����������зֱ��������ʵ�����CH4��CO2��ʹ�ס�����������ʼ�ݻ���ȣ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䣮��֪��������CH4��ת������ʱ��仯��ͼ����ͼ3��ʾ������ͼ3�л�����������CH4��ת������ʱ��仯��ͼ��
��3����Ӧ���С�H3= ��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K=1��0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���
| CO | H2O | CO2 | H2 |
| 0��5mol | 8��5mol | 2��0mol | 2��0mol |
��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵʽ�� ������ţ���
a��v��������v���棩 b��v��������v���棩
c��v������=v���棩 d�����жϣ�
�״�����Ҫ�Ļ�ѧ��ҵ����ԭ�Ϻ����Һ��ȼ�ϡ���ҵ�Ͽ�����CO��CO2������ȼ�ϼ״�����֪�״��Ʊ����йػ�ѧ��Ӧ�Լ��ڲ�ͬ�¶��µĻ�ѧ��Ӧƽ�ⳣ�����±���ʾ��
| ��ѧ��Ӧ | ƽ�ⳣ�� | �¶ȡ� | |
| 500 | 800 | ||
��2H2(g)+CO(g) CH3OH(g) CH3OH(g) | K1 | 2.5 | 0.15 |
��H2(g)+CO2(g) H2O (g)+CO(g) H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
��3H2(g)+CO2(g) CH3OH(g)+H2O (g) CH3OH(g)+H2O (g) | K3 | | |
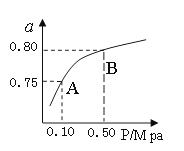
��1����Ӧ���� ������ȡ����ȡ�����Ӧ��
��2��ij�¶��·�Ӧ����H2��ƽ��ת���ʣ�a������ϵ��ѹǿ(P)�Ĺ�ϵ����ͼ��ʾ����ƽ��״̬��A�䵽Bʱ��ƽ�ⳣ��K(A) K(B)������������������������ݷ�Ӧ����ڿ��Ƶ���K1��K2��K3֮��Ĺ�ϵ����K3= ����K1��K2��ʾ����
��3����3 L�ݻ��ɱ���ܱ������з�����Ӧ�ڣ���֪c(CO)�뷴Ӧʱ��t�仯���ߢ���ͼ��ʾ������t0ʱ�̷ֱ�ı�һ�����������ߢ��Ϊ���ߢ�����ߢ�

�����ߢ��Ϊ���ߢ�ʱ���ı�������� ��
�����ߢ��Ϊ���ߢ�ʱ���ı�������� ��
��4���״�ȼ�ϵ�����Ź㷺����;��ͬʱAl-AgO�����Ӧ�ù㷺���� ��أ���ԭ����ͼ��ʾ���õ�صĸ�����Ӧʽ��

��5��һ�������¼״���һ����̼��Ӧ���Ժϳ����ᡣͨ��״���£���a mol/L�Ĵ�����b mol/LBa(OH)2��Һ�������ϣ���Ӧƽ��ʱ��2c(Ba2��)= c(CH3COO��)���ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ ��
 C(g)+D(g)��H��0�ش��������⣺
C(g)+D(g)��H��0�ش��������⣺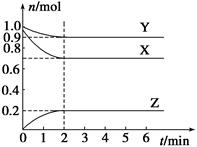
 CO2(g)ʮH2 (g) ��H<0 �� CO��H2OŨ�ȱ仯����ͼ��
CO2(g)ʮH2 (g) ��H<0 �� CO��H2OŨ�ȱ仯����ͼ��
 2NH3(g)��Ӧ��Ӱ�죬ʵ�����ɱ�ʾ����ͼ��ʾ�Ĺ��ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������
2NH3(g)��Ӧ��Ӱ�죬ʵ�����ɱ�ʾ����ͼ��ʾ�Ĺ��ɣ�ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�������

 4NO��6H2O ��4NH3��3O2
4NO��6H2O ��4NH3��3O2