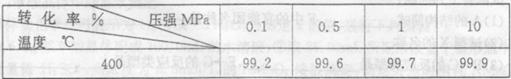
题目内容
在体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)  CO2(g)十H2 (g) △H<0 , CO和H2O浓度变化如下图,
CO2(g)十H2 (g) △H<0 , CO和H2O浓度变化如下图,
(1) 3min—4min之间反应处于____状态(填平衡、不平衡);
(2)要使反应在8min后,平衡向逆方向移动,可采取的措施是__ ___,要使反应在8min后,反应速率降低,平衡向正方向移动,可采取的措施是________。(填a,b,c,d)
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)求出850℃ 时,该反应的平衡常数和CO的平衡转化率(写出详细计算过程)
(1) 不平衡 (2) d , b (各2分)
(3)0.6 (2分)
解析试题分析:
(1)由图可知3min—4min之间物质的浓度在变化。所以不平衡
(2)a.增加水蒸气,衡向正方向移动 b.降低温度,平衡向逆方向移动 c.使用催化剂,不改变平衡。 d.增加氢气浓度,反应速率降低,平衡向正方向移动。
(3) CO(g) 十 H2O(g)  CO2(g) 十 H2 (g)
CO2(g) 十 H2 (g)
初始浓度(mol/L) 0.2 0.3 0 0
变化浓度(mol/L) 0.12 0.12 0.12 0.12
平衡浓度(mol/L) 0.08 0.18 0.12 0.12
K = c(CO2) c(H2) / c(CO) c(H2O) =" (" 0.12 mol/L *0.12 mol/L ) / (0.08 mol/L* 0.18 mol/L) = 1
CO的平衡转化率 =" 0.12" mol/L / 0.2 mol/L = 0.6
考点:化学反应速率和化学平衡综合考察

制取尿素[CO(NH2)2]的反应:2NH3(g)+CO2(g) 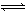 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)
某温度下体积为10L的密闭容器中,测得各物质的物质的量数据如下:
| 物质的量mol | 0min | 2 min | 3 min | 4 min |
| NH3 | 2.0 | 1.4 | n1 | n1 |
| CO2 | 1.0 | 0.7 | n2 | n2 |
| H2O | 0 | 0.3 | n3[ | n3 |
(1)根据表中数据计算0~2min内NH3的平均反应速率 ,若起始时与平衡时的气体总压强之比为15/11,n1= mol。
(2)该温度下此反应的平衡常数表达式为
(3)下列各项能表示该反应达到平衡状态是 。
A.消耗NH3的物质的量与生成H2O的物质的量之比为2∶1
B.c(NH3):c(CO2):c(H2O)=2∶1∶1
C.气体密度不再变化
D.容器压强不再变化
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
CO2+H2(g)反应过程中测定的部分数据见下表(表中t1>t2):
| 反应时间/min | n(CO)/mol | n(H2O)/ mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
(1)反应在t1min内的平均速率为v(H2)= mol·L-1·min-1
(2)保持其他条件不变,起始时向容器中充入0.60molCO和1.20 molH2O,到达平衡时,n(CO2)= mol。
(3)保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率 (填“增大”或“减小”或“不变” 下同),H2O的体积分数
(4)温度升至800℃,该反应平衡常数为0.64,则正反应为 反应(填“放热”或“吸热”)。
研究NO2、、CO等大气污染气体的处理具有重要意义。
利用反应6NO2(g)+8NH3(g) 7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
7N2(g)+12 H2O(g)可处理NO2。700℃时,向容积为2L的密闭容器中充入一定量的NO2和NH3, 反应过程中测定的部分数据见下表
| 反应时间/min | n(NO2)/mol | n(NH3)/ mol |
| 0 | 1.20 | 1.60 |
| 2 | 0.90 | |
| 4 | | 0.40 |
4min该反应达到平衡状态,则该反应的平衡常数K的表达式为 ,NO2的转化率为
(2) 700℃ ,将NO2与NH3以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变 b.混合气体颜色保持不变
c.体系密度保持不变 d.每消耗1 mol NO2的同时生成2 mol H2O
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
 CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变)
CH3OH(g)。200℃时,向在一个带活塞的密闭真空容器中中充入一定量的CO和H2发生上述反应,压缩容器的容积为原来的一半,平衡将 移动(填向左,向右,不);CO的浓度将 (增大,减小,不变) 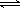 2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。
2SO3(g);△H=-196 kJ/mo1,850K时,在2L固定容积的密闭容器中充入2mol SO2和2mol O2,10分钟后达到平衡,SO2浓度和时间关系如图。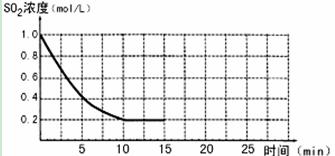
 cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(△H<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示: 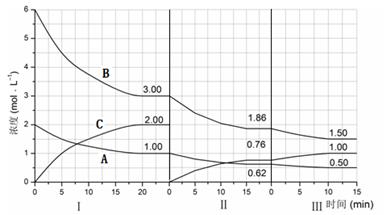

 2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图
2SO3(g),平衡混合体系中SO3的百分含量和温度的关系如图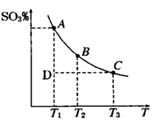 所示,根据图回答下列问题:
所示,根据图回答下列问题:
 pC达到平衡,若:
pC达到平衡,若: