题目内容
下列离子方程式正确的是( )
A.乙酸与碳酸钠溶液反应:2H++CO == CO2↑+H2O == CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应:CH3COOH+OH— —→CH3COO-+H2O |
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O—→ 2C6H5OH+CO |
D.用银氨溶液检验乙醛中的醛基:CH3CHO +2[Ag(NH3)2]+ + 2OH- CH3COO-+ NH4+ +3NH3 + 2Ag↓+ H2O CH3COO-+ NH4+ +3NH3 + 2Ag↓+ H2O |
D
解析试题分析:A选项,乙酸为若电解质,不能拆分。错误。B选项,氢氧化铜为沉淀,不能拆分。错误。C选项,苯酚钠与二氧化碳反应,产物得到的为碳酸氢钠。题中为碳酸根,错误。D选项正确。
考点:离子反应方程式书写。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
在下列溶液中,各组离子一定能够大量共存的是( )
| A.25℃由水电离的c(H+)= 10-12mol/L 的溶液:Fe3+ Cl-NO3- K+ |
| B.使酚酞变红的溶液:Na+ Cl- SO42-AlO2- |
| C.某无色溶液:HCO3-NO3- Al3+ Ba2+ |
| D.25℃时,pH=1的溶液: Ba2+ NO3- K+ I- |
在一定体积pH="12" 的 Ba(OH)2溶液中,逐滴滴加一定物质的量浓度的 NaHSO4溶液,当溶液中的Ba2+ 恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与 NaHSO4溶液的体积比是( )
| A.1:9 | B.1:1 | C.1:2 | D.1:4 |
下列物质的电离方程式正确的是
A.H2CO3 2H++CO32- 2H++CO32- | B.HClO=H++ClO- |
C.NaHCO3 Na++HCO3- Na++HCO3- | D.Ba(OH)2=Ba2++2OH- |
已知某酸性溶液中含有Ba2+、Fe3+,则下述离子组中能与上述离子共存的是( )。
| A.CO32—、Cl— | B.NO3—、Cl— |
| C.NO3—、SO42— | D.OH—、NO3— |
在强酸性溶液中,下列离子组能大量共存且溶液为澄清透明的是
| A.K+、Na+、CO32-、MnO4- | B.Na+、K+、Cl-、HCO3- |
| C.Na+、Cu2+、SO42-、NO3- | D.Ba2+、SO42-、NO3-、K+ |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使石蕊试液变红的溶液:Na+、K+、Cl-、CO32- |
| B.1.0mol·L-1的HNO3溶液:K+、Cu2+、Cl-、SO42- |
| C.含有I-的溶液:Na+、Fe3+、Cl-、SO42- |
| D.加入Al能放出H2的溶液:Cl-、SO42-、NO3-、Mg2+ |
下列反应的离子方程式正确的是
A.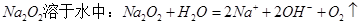 |
B.用FeC13溶液腐蚀电路板: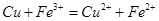 |
C.向 溶液中通入过量 溶液中通入过量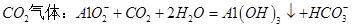 |
D.用食醋除去水瓶中的水垢: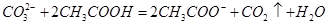 |
某工业废水含有下列离子中的5种,K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,且各种离子的物质的量浓度相等。甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是:( )
| A.溶液中难以确定Al3+的存在与否 |
| B.原溶液中所含的离子为:Cu2+、Fe2+、Cl-、NO3-、SO42- |
| C.步骤②中可以确定Fe2+、NO3-的存在,不能确定其它离子的存在 |
| D.步骤③中的白色沉淀为2种钡盐 |