题目内容
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.使石蕊试液变红的溶液:Na+、K+、Cl-、CO32- |
| B.1.0mol·L-1的HNO3溶液:K+、Cu2+、Cl-、SO42- |
| C.含有I-的溶液:Na+、Fe3+、Cl-、SO42- |
| D.加入Al能放出H2的溶液:Cl-、SO42-、NO3-、Mg2+ |
B
解析试题分析:A.使石蕊试液变红的溶液呈酸性,不能大量存在CO32-,错误;B正确;C.含有I-的溶液中不能存在Fe3+会发生氧化还原反应。D.加入Al能放出H2的溶液要么呈强碱性或酸性,Mg2+不能在碱性溶液中存在,故错误;
考点:考查离子的共存问题。

练习册系列答案
相关题目
下列说法中,正确的是
| A.SO2水溶液能导电,所以SO2是电解质 |
| B.Na2CO3既是钠盐又是碳酸盐 |
| C.向醋酸溶液中加入少量氢氧化钠固体,由于发生中和反应,溶液的导电能力降低 |
| D.NaCl溶液能导电所以NaCl溶液是电解质 |
能用H++OH-=H2O表示的是
| A.Ba(OH)2溶液和稀H2SO4的反应 | B.NaOH溶液和盐酸反应 |
| C.Cu(OH)2和稀H2SO4的反应 | D.NaOH溶液和CO2的反应 |
下列离子方程式正确的是( )
A.乙酸与碳酸钠溶液反应:2H++CO == CO2↑+H2O == CO2↑+H2O |
| B.醋酸溶液与新制氢氧化铜反应:CH3COOH+OH— —→CH3COO-+H2O |
C.苯酚钠溶液中通入少量二氧化碳:2C6H5O-+CO2+H2O—→ 2C6H5OH+CO |
D.用银氨溶液检验乙醛中的醛基:CH3CHO +2[Ag(NH3)2]+ + 2OH- CH3COO-+ NH4+ +3NH3 + 2Ag↓+ H2O CH3COO-+ NH4+ +3NH3 + 2Ag↓+ H2O |
下列溶液中的各组离子,通入过量SO2气体后仍能大量存在的是
| A.Ba2+、Ca2+、Cl- | B.OH-、CO32-、Na+ |
| C.Ca2+、ClO-、Cl- | D.H+、Fe3+、NO3- |
已知:Fe2+结合S2-的能力大于结合OH-的能力,而Al3+则正好相反,I2的氧化性比S强。在Fe2(SO4)3和AlCl3的混合溶液中,先加入过量的KI溶液,再加入足量的Na2S溶液,所得沉淀是
| A.Fe2S3和 Al(OH)3 | B.Fe(OH)3和Al(OH)3 |
| C.FeS、Al(OH)3和S | D.Al2S3、FeS和S |
描述或解释下列现象的离子方程式,不正确的是( )
A.氢氧化钠溶液中滴入紫色石蕊试液,再通入CO2,溶液有蓝变红:CO2+2OH-=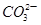 +H2O +H2O |
| B.漂白粉溶液中加氯化铁溶液产生大量红褐色沉淀:Fe3++3ClO-+3H2O=Fe(OH)3↓+3HClO |
| C.Cl2通入FeBr2溶液中,Cl2与FeBr2物质的量之比4︰5:10Fe2++6Br-+8Cl2=10Fe3++3Br2+16Cl- |
D.碳酸氢铵溶液中加足量澄清石灰水: + +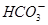 +Ca2++2OH-=CaCO3↓+NH3·H2O+H2O +Ca2++2OH-=CaCO3↓+NH3·H2O+H2O |
下列物质中,不属于电解质的是
| A.蔗糖 | B.NaCl | C.NaOH | D.H2SO4 |