题目内容
【题目】![]() 和
和![]() 是钍的两种同位素,
是钍的两种同位素,![]() 可以转化成
可以转化成![]() 。下列有关Th的说法正确的是
。下列有关Th的说法正确的是
A. Th元素的质量数是232
B. Th元素的相对原子质量是231
C. ![]() 转化成
转化成![]() 是化学变化
是化学变化
D. ![]() 和
和![]() 的化学性质相同
的化学性质相同
【答案】D
【解析】
A.Th元素有2种核素;
B.元素的相对原子质量是按各种天然同位素原子所占的一定百分比算出来的平均值;
C.有新物质生成的是化学变化;
D.同位素的化学性质几乎相同。
A.Th元素有2种核素,![]() 和
和![]() 的质量数分别是230,232,A错误;
的质量数分别是230,232,A错误;
B.不知道各种天然同位素的含量无法求出Th元素的相对原子质量,B错误;
C.化学变化是生成新物质的变化,原子不变,而![]() 转化成
转化成![]() 的原子发生变化,不是化学变化,C错误;
的原子发生变化,不是化学变化,C错误;
D.同位素的物理性质可以不同,但化学性质几乎相同,D正确。
答案选D。

 全优点练单元计划系列答案
全优点练单元计划系列答案【题目】汽车尾气中含有CO、NO等有害气体。
(1)汽车尾气中NO生成过程的能量变化示意图如下:

该条件下,1mol N2和1molO2完全反应生成NO,会____(填“吸收”或“放出”)_____kJ能量。
(2)化学电池在通讯、交通及日常生活中有着广泛的应用。目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:Cd+2NiO(OH)+2H2O![]() 2Ni(OH)2+Cd(OH)2。
2Ni(OH)2+Cd(OH)2。
①已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,放电就是使用电池的过程,充电是给电池补充电量的过程。以下说法中正确的是______。
A. 以上反应不属于置换反应 B.以上反应是可逆反应
C. 充电时化学能转变为电能 D.放电时化学能转变为电能
②写出负极的电极反应式________________________________________。
③废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍锡电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为____________。
(3)一种新型催化剂能使NO和CO发生反应:2NO+2CO![]() 2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
2CO2+N2。已知增大催化剂的比表面积可提高该反应速率。为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | 280 | 1.20×10-3 | B | 124 |
Ⅲ | 350 | A | 5.80×10-3 | 82 |
①请把表中数据补充完整:A_______________;B_______________。
②能验证温度对化学反应速率影响规律的是实验______________(填实验序号)。
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如下图所示,其中表示实验Ⅱ的是曲线_________(填“甲”或“乙”)。

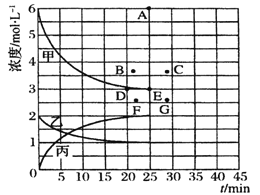
【题目】工业合成氨反应为Nz(g)+3H2(g) ![]() 2NH3(g),对其研究如下:在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1L 的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表;
2NH3(g),对其研究如下:在773 K时,分别将2 mol N2和6 mol H2充入一个固定容积为1L 的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1) 前10min 中利用N2表示的反应速率为________
(2) 该温度下,此反应的平衡常数K=__________
(3) 该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3 mol·L-1、3 mol·L-1、3 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
(4) 该温度下,在上述平衡体系中再通入2molNH3,一段时间后,达到新的平衡。此时c(H2)____ 4.5mo1/L(填“>”、“<”或“=”)。
(5) 由上表中的实验数据计算得到“浓度-时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______。在此温度下,若起始充入4 mol Nz 和12 mol Hz,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_______。