题目内容
20.鸡蛋清溶液遇到浓HNO3,颜色变成黄色.在鸡蛋清溶液中加入浓的Na2SO4溶液,可以使蛋白质凝聚而从溶液中析出,此变化叫蛋白质的盐析,盐析是一个可逆(填“可逆”或“不可逆”)的过程,通常是物理(填“物理”或“化学”)变化.分析 蛋白质遇浓硝酸发生颜色反应,盐析是可逆的,是物理变化.
解答 解:含有苯环的蛋白质遇浓硝酸发生颜色反应,盐析一般是指溶液中加入无机盐类而使某种物质溶解度降低而析出的过程,盐析是可逆的,是物理变化,故答案为:黄;可逆;物理.
点评 本题考查氨基酸、蛋白质的结构和性质特点,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目
11.下列图示实验操作规范或能达到实验目的是( )
| A. | 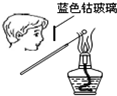 检验K+的存在 | B. |  | C. |  干燥氯气 | D. |  |
8.下列实验中所选用的仪器或者所测数据合理的是( )
| A. | 用精密pH试纸测定血液的pH为7.40 | |
| B. | 用碱式滴定管量取20.10mLKMnO4酸性溶液 | |
| C. | 用托盘天平称取8.56g食盐 | |
| D. | 用250mL容量瓶配制所需的230mL0.2 mol•L-1的氢氧化钠溶液 |
15.常温时,下列溶液的pH或微粒的物质的量浓度关系正确的是( )
| A. | 某溶液中由水电离出的c(H+)=1×10-a mol/L,若a>7时,该溶液pH一定为14-a | |
| B. | 已知某温度Ksp(Ag2S)=6×10-30,Ksp(AgCl)=2×106,则2AgCl(g)+S2-(aq)?Ag2S(s)+2Cl-(aq)的平衡常数y约为6.7×10-37 | |
| C. | 在25℃,将2amol•L-1的氨水与0.02mol•L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3•H2O的电离常数K1=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 等体积、等物质的量浓度的Na2CO3溶液与NaHCO3溶液混合:3c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) |
12.下列指定反应的离子方程式正确的是( )
| A. | Fe2O3溶于氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+CO32- | |
| C. | NH4HCO3溶于过量的浓KOH溶液:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2S${O}_{4}^{2-}$═2BaSO4↓+Al(OH)3↓ |
9.下列反应中,属于吸热反应的是( )
| A. | Ba(OH)2.8H2O与NH4Cl反应 | B. | 铝与稀盐酸 | ||
| C. | NaOH与HCl的反应 | D. | 甲烷与O2的燃烧反应 |
10.在恒容密闭容器中进行N2+3H2═2NH3反应,起始时N2和H2分别为10mol和30mol,当达到平衡时,N2的转化率为30%.若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是( )
| A. | 40 mol 35% | B. | 20 mol 30% | C. | 20 mol 70% | D. | 10 mol 50% |
 按如图装置进行实验,并回答下列问题
按如图装置进行实验,并回答下列问题