题目内容
12.下列指定反应的离子方程式正确的是( )| A. | Fe2O3溶于氢碘酸溶液中:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+CO32- | |
| C. | NH4HCO3溶于过量的浓KOH溶液:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2S${O}_{4}^{2-}$═2BaSO4↓+Al(OH)3↓ |
分析 A.三价铁离子能够氧化碘离子,二者不共存;
B.二氧化碳过量反应生成碳酸氢钠;
C.二者反应生成碳酸钠、水和氨气;
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,生成产物为硫酸钡、偏铝酸钾和水.
解答 解:A.氧化铁可溶于氢碘酸,三价铁具有氧化性能氧化碘离子,反应的离子方程式为:Fe2O3+2I-+6H+=2Fe2++3H2O+I2;故A错误;
B.向NaAlO2溶液中通入过量CO2,反应生成氢氧化铝和碳酸氢钠,离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故B错误;
C.NH4HCO3溶于过量的浓KOH溶液,离子方程式:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O,故C正确;
D.明矾[KAl(SO4)2]溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀,硫酸铝钾与氢氧化钡的物质的量之比为1:2,反应生成偏铝酸钠,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选:C.
点评 本题考查了离子方程式的判断,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等即可解答,题目难度不大.

练习册系列答案
相关题目
3.已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO4•5H2O(s)═CuSO4(s)+5H2O(l);△H=+Q2 kJ•mol?1则Q1、Q2的关系为( )
| A. | Q1>Q2 | B. | Q1<Q2 | C. | Q1=Q2 | D. | 无法确定 |
17.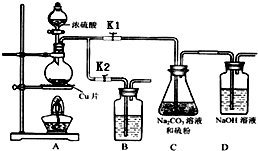 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
已知:①Na2S2O3在酸性溶液中不能稳定存在;
②硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-.
(Ⅰ)制备Na2S2O3•5H2O
①打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热.圆底烧瓶中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②C中混合液被气流搅动,反应一段时间后,
硫粉的量逐渐减少.
C中碳酸钠的作用是提供碱性环境,作反应物.
D中可能发生的离子反应方程式为:SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O.
“停止C中的反应”的操作是打开K2,关闭K1.
③过滤C中的混合液.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
④装置B中盛放的试剂是(填化学式)NaOH溶液,其作用是在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染.
(Ⅱ)用I2的标准溶液测定产品的纯度
取5.5g产品,配制成100mL溶液.取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示.
(1)滴定时,达到滴定终点的现象是加入最后一滴I2标准溶液后,溶液变蓝,且半分钟内颜色不改变.
(2)Na2S2O3•5H2O在产品中的质量分数是90.2%(用百分数表示,且保留1位小数).
 硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.
硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得.已知:①Na2S2O3在酸性溶液中不能稳定存在;
②硫代硫酸钠与碘反应的离子方程式为:2S2O32-+I2→S4O62-+2I-.
(Ⅰ)制备Na2S2O3•5H2O
①打开K1,关闭K2,向放有铜片的圆底烧瓶中加入足量浓硫酸,加热.圆底烧瓶中发生反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
②C中混合液被气流搅动,反应一段时间后,
硫粉的量逐渐减少.
C中碳酸钠的作用是提供碱性环境,作反应物.
D中可能发生的离子反应方程式为:SO2+2OH-=SO32-+H2O、CO2+2OH-=CO32-+H2O.
“停止C中的反应”的操作是打开K2,关闭K1.
③过滤C中的混合液.将滤液加热浓缩、冷却结晶、过滤、洗涤、烘干,得到产品.
④装置B中盛放的试剂是(填化学式)NaOH溶液,其作用是在C中的反应停止后,吸收A中产生的多余SO2,防止空气污染.
(Ⅱ)用I2的标准溶液测定产品的纯度
取5.5g产品,配制成100mL溶液.取10.00mL溶液,以淀粉溶液为指示剂,用浓度为0.050mol/L I2的标准溶液进行滴定,相关数据记录如下表所示.
| 编号 | 1 | 2 | 3 |
| 溶液的体积/mL | 10.00 | 10.00 | 10.00 |
| 消耗I2标准溶液的体积/mL | 19.95 | 17.10 | 20.05 |
(2)Na2S2O3•5H2O在产品中的质量分数是90.2%(用百分数表示,且保留1位小数).
4.金属A和非金属B可以直接化合生成化合物AxBy.甲、乙两同学分别做A和B化合的实验,每人所用A和B的质量不相同,但总质量都是12g,甲、乙所用A、B质量和得到的化合物AxBy的质量如下:
则A、B所发生的反应可能为( )
| A | B | AxBy | |
| 甲 | 8g | 4g | 11g |
| 乙 | 7g | 5g | 11g |
| A. | 2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO | B. | Fe+S $\frac{\underline{\;\;△\;\;}}{\;}$ FeS | ||
| C. | 3Fe+2O2$\frac{\underline{\;\;△\;\;}}{\;}$ Fe3O4 | D. | 2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3 |
1.表中对于相关物质的分类全部正确的一组是( )
| 纯净物 | 混合物 | 盐 | 电解质 | 碱性氧化物 | |
| A | 氯水 | 蔗糖 | 纯碱 | NaHCO3 | 氧化铝 |
| B | 稀硫酸 | 水玻璃 | 小苏打 | NH3•H2O | 氧化镁 |
| C | 冰 | 王水 | 苏打 | H2SiO3 | 过氧化钠 |
| D | 乙醇 | 碘化银胶体 | 碱式碳酸铜 | NaOH | 氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
2.实验测得:101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量;1mol CH4完全燃烧生成液态水和CO2,放出890.3kJ的热量.下列热化学方程式的书写正确的是( )
| A. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=+890.3kJ•mol-1 | |
| B. | CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ•mol-1 | |
| C. | H2(g)+12O2(g)═H2O(g)△H=-285.8kJ•mol-1 | |
| D. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1 |