题目内容
6.某研究性学习小组探究FeSO4的化学性质和用途.回答下列问题:(一)探究FeSO4溶液的酸碱性:
取少量FeSO4固体,利用石蕊试液测试FeSO4溶液的酸碱性,必须选用的仪器有胶头滴管、药匙和B.
A.玻璃棒 B.试管 C.天平 D.量筒
(二)利用下图装置探究FeSO4的稳定性
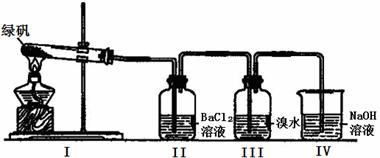
Ⅱ中有白色沉淀生成,小组成员结合理论分析,认为下列分解产物不可能的是A.
A.Fe2O3、SO3、H2O B.Fe2O3、SO2、SO3、H2O
C.FeO、Fe2O3、SO2、SO3、H2O
Ⅲ中溴水是用来检验是否有 SO2气体生成,若有SO2生成,溴水将褪色.实验中,观察到溴水褪色,据此推测FeSO4分解最有可能被氧化的元素是Fe.NaOH的作用是吸收SO2气体,请 写出最大量吸收SO2气体的反应化学方程式:2NaOH+SO2=Na2SO3+H2O.
(三)探究FeSO4中Fe2+还原性:
证明FeSO4有较强的还原性,完成下表.
| 实验步骤 | 实验预期现象及结论 |
| 步骤一:取少量的FeSO4 固体于试管中,加入一定量水溶解 | |
| 步骤二: |
缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是防止硫酸亚铁被氧化.
分析 (一)依据实验基本操作分析,取溶液少许与试管中,滴入石蕊试液检验;
(二)Ⅱ、依据氧化还原反应的特征化合价有升必有降来分析;
Ⅲ、FeSO4中亚铁离子据有还原性;二氧化硫与NaOH溶液反应生成亚硫酸钠和水,据此书写方程式;
(三)FeSO4有较强的还原性,很容易被氧化剂氧化为硫酸铁,加入氧化剂以后检验铁离子的存在即可;
(四)硫酸亚铁和溶容易被空气中的氧气氧化,据此回答.
解答 解:(一)取药匙取少量Na2S2O3固体与试管中溶解,用胶头滴管滴入石蕊试液测定Na2S2O3溶液的酸碱性,必须选用的仪器有胶头滴管、药匙、试管,
故答案为:B;
(二)Ⅱ、依据氧化还原反应的特征化合价有升必有降,
A.Fe2O3、SO3、H2O化合价只有铁升高了,没有降低的,故A不可能;
B.Fe2O3、SO2、SO3、H2O铁升高硫降低了,故B可能;
C.FeO、Fe2O3、SO2、SO3、H2O铁升高硫降低了,故C可能;
故选:A;
Ⅲ、FeSO4中亚铁离子据有还原性,所以最有可能被氧化的元素是Fe,二氧化硫和氢氧化钠反应生成亚硫酸钠和水,反应方程式为2NaOH+SO2=Na2SO3+H2O,故答案为:Fe;2NaOH+SO2=Na2SO3+H2O;
(三)FeSO4有较强的还原性,很容易被氧化剂氧化为硫酸铁,加入氧化剂以后检验铁离子的存在即可,操作是:取少量的FeSO4固体与试管中,加入一定量水溶解,向其中加入氯水后再加入硫氰化钾溶液,如果溶液变红色,可以证明硫酸亚铁的强还原性,
故答案为:滴入氯水后,再滴入KSCN溶液;溶液变红,证明硫酸亚铁具有强的还原性;
(四)硫酸亚铁和溶容易被空气中的氧气氧化,缺铁性贫血往往口服硫酸亚铁,当用硫酸亚铁制成药片时,外表包有一层特殊的糖衣,其作用是防止硫酸亚铁被氧化,
故答案为:防止硫酸亚铁被氧化.
点评 本题考查学生亚铁离子的性质、铁离子的检验以及物质之间的化学方程式的书写知识,属于实验方案的设计探究题,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | FeCl2 | B. | Na2O | C. | Fe( OH)3 | D. | H2SiO3 |
| A. | 选择不同催化剂,可以改变反应速率,不改变△H | |
| B. | 及时分离液态硫,能提高SO2的转化率 | |
| C. | 在恒容恒温容器中反应,气体压强不变时达到平衡状态 | |
| D. | 升高温度,正、逆反应速率均增大,n(CO)增大 |
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含Br2(填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含Fe3+所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 | b | 下层(CCl4层)无色 |
| 方案2 | d | 溶液变为血红色 |
①在足量的稀氯化亚铁溶液中加入l~2滴溴水,溶液呈黄色,所发生的离子反应方程式为2Fe2++Br2═2Fe3++2Br-.
②在FeBr2溶液中通入足量 Cl2,所发生的离子反应方程式为4Fe2++2Br-+3Cl2═4Fe3++Br2+6Cl-.
| A. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的核外电子数相同,是同一种核素 | |
| B. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的中子数相同,互称为同位素 | |
| C. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质子数相同,互称为同位素 | |
| D. | 于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的质量数相同,不能互称为同位素 |
| A. | NaHS在水中的电离方程式为NaHS═Na++H++S2- | |
| B. | NaHS溶液水解的离子方程式为HS-+H2O═H2S↑+OH- | |
| C. | NaHS溶液与FeSO4溶液反应的离子方程式为S2-+Fe2+═FeS↓ | |
| D. | 向NaHS溶液中滴加过量的新制氯水:HS-+Cl2═S↓+H++2Cl- |
 三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )
三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(如图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(如图2),若原料完全反应生成三氯异氰尿酸.则氰尿酸和次氯酸的物质的量之比应为( )