题目内容
(10分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T的单质既可与盐酸反应,又可与NaOH溶液反应,请回答下列问题:
(1)T的原子结构示意图为_______________。
(2)元素的非金属性为(原子的得电子能力):Q______ R (填“强于”或“弱于”)
3)、T的硫酸盐溶液与过量NaOH溶液反应的离子方程式为 。
4)请写出R与氢形成的氢化物的电子式
5)、Q、R、T、W的原子半径由大到小的顺序为
| | Q | R | |
| T | | | W |
(2)元素的非金属性为(原子的得电子能力):Q______ R (填“强于”或“弱于”)
3)、T的硫酸盐溶液与过量NaOH溶液反应的离子方程式为 。
4)请写出R与氢形成的氢化物的电子式
5)、Q、R、T、W的原子半径由大到小的顺序为
(1)、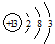 (2)、弱于 (3)、Al3++4OH- = AlO2-+2H2O
(2)、弱于 (3)、Al3++4OH- = AlO2-+2H2O
(4)、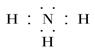 (5)、T>W>Q>R
(5)、T>W>Q>R
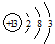 (2)、弱于 (3)、Al3++4OH- = AlO2-+2H2O
(2)、弱于 (3)、Al3++4OH- = AlO2-+2H2O(4)、
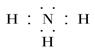 (5)、T>W>Q>R
(5)、T>W>Q>R考查元素周期表的结构和元素周期律的应用。T的单质既可与盐酸反应,又可与NaOH溶液反应,所以T是铝,则根据元素在周期表中的位置可判断,Q是碳,R是氮,W是硫。
(1)铝位于第三周期第ⅢA,结构示意图为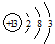 。
。
(2)同周期自左向右非金属性逐渐增强,所以碳的非金属性弱于氮的。
(3)氢氧化铝是两性氢氧化物,能溶于氢氧化钠溶液中,反应式为Al3++4OH- = AlO2-+2H2O。
(4)氮和氢都是非金属,形成的化学键是极性键,所以氨气的电子式为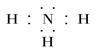 。
。
(5)同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,所以原子半径大小顺序为T>W>Q>R。
(1)铝位于第三周期第ⅢA,结构示意图为
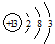 。
。(2)同周期自左向右非金属性逐渐增强,所以碳的非金属性弱于氮的。
(3)氢氧化铝是两性氢氧化物,能溶于氢氧化钠溶液中,反应式为Al3++4OH- = AlO2-+2H2O。
(4)氮和氢都是非金属,形成的化学键是极性键,所以氨气的电子式为
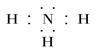 。
。(5)同主族自上而下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,所以原子半径大小顺序为T>W>Q>R。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目