题目内容
ⅰ已知A是气态烃,完全燃烧时产生的CO2和H2O 的物质的量之比为1:1,A的相对分子质量小于30,在下图变化中,F为高分子化合物,C中含有-CHO,E有水果的香味(反应条件未写出)
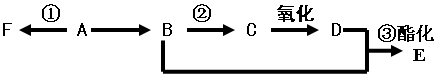
(1)B中所含官能团名称 ,E 物质的名称 ;
(2)反应①类型为 。
(3)写出下列反应的化学方程式(注明反应条件)
① ;
② ;
③ ;
ⅱ一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为 g.
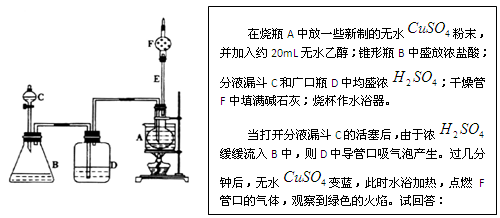
ⅲ某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(乙醛易溶于水),图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:
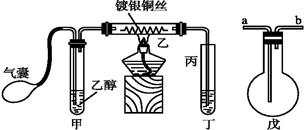
(1)甲装置常常浸在70~80 ℃的水浴中,目的是 。
(2)由于装置设计上的缺陷,实验进行时可能会 。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):
乙接 、 接丙。

(1)B中所含官能团名称 ,E 物质的名称 ;
(2)反应①类型为 。
(3)写出下列反应的化学方程式(注明反应条件)
① ;
② ;
③ ;
ⅱ一定量的乙醇在氧气不足的情况下燃烧,得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为 g.
ⅲ某课外活动小组利用下图装置进行乙醇的催化氧化实验并制取乙醛(乙醛易溶于水),图中铁架台等装置已略去,粗黑线表示乳胶管。请填写下列空白:

(1)甲装置常常浸在70~80 ℃的水浴中,目的是 。
(2)由于装置设计上的缺陷,实验进行时可能会 。
(3)若试管丁中用水吸收产物,则要在导管乙、丙之间接上戊装置,其连接方法是(填戊装置中导管代号):
乙接 、 接丙。
ⅰ(1) 羟基(1分) 乙酸乙酯(1分)(2) 加聚反应 (1分)
(3)① n CH2=CH
 (3分)
(3分)
②2CH3CH2OH + O2 2CH3CHO + 2H2O (3分)
2CH3CHO + 2H2O (3分)
③CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O (3分)(用可逆符号也可以)
CH3COOCH2CH3 + H2O (3分)(用可逆符号也可以)
ⅱ1.4g (3分)
ⅲ(1)使生成乙醇蒸气的速率加快且较均匀 (2分) ( “速率加快”1分,“均匀”1分)
(2)发生倒吸 (2分) (3)b a (2分)
(3)① n CH2=CH

 (3分)
(3分)②2CH3CH2OH + O2
 2CH3CHO + 2H2O (3分)
2CH3CHO + 2H2O (3分)③CH3CH2OH + CH3COOH
 CH3COOCH2CH3 + H2O (3分)(用可逆符号也可以)
CH3COOCH2CH3 + H2O (3分)(用可逆符号也可以)ⅱ1.4g (3分)
ⅲ(1)使生成乙醇蒸气的速率加快且较均匀 (2分) ( “速率加快”1分,“均匀”1分)
(2)发生倒吸 (2分) (3)b a (2分)
试题分析:ⅰ、已知A是气态烃,完全燃烧时产生的CO2和H2O 的物质的量之比为1:1,则A分子中碳氢原子的个数之比是1:2,所以最简式为CH2。又因为A的相对分子质量小于30,所以A的化学式是C2H4,即A是乙烯。乙烯含有碳碳双键,能发生加成反应和加聚反应以及氧化反应等。由于F为高分子化合物,C中含有-CHO,E有水果的香味,所以F是聚乙烯,乙烯与水发生加成反应生成乙醇,则B是乙醇。乙醇氧化生成乙醛,即C是乙醛。乙醛氧化生成乙酸,即D是乙酸。乙酸和乙醇发生酯化反应生成乙酸乙酯,则E是乙酸乙酯。
(1)乙醇分子中的官能团是羟基;E的名称是乙酸乙酯。
(2)乙烯发生加聚反应生成聚乙烯,所以反应①的反应类型是加聚反应。
(3)根据以上分析可知,反应①、②、③的方程式分别是是 n CH2=CH

 、2CH3CH2OH + O2
、2CH3CH2OH + O2 2CH3CHO + 2H2O、CH3CH2OH + CH3COOH
2CH3CHO + 2H2O、CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O。
CH3COOCH2CH3 + H2O。ⅱ、设乙醇的物质的量为x,由关系式可知C2H5OH~3H2O
1mol 54g
x 10.8g
解得x=
 =0.2mol
=0.2mol因此根据碳原子守恒可知n(CO2)+n(CO)=0.2mol×2=0.4mol
又因为m(CO2)+m(CO)=27.6g-10.8g=16.8g
设CO2和CO的物质的量分别是a和b,则44g/mol×a+28g/mol×b=16.8g、a+b=0.4mol
解得a=0.35mol、b=0.05mol
所以m(CO)=0.05mol×28g/mol=1.4g
ⅲ、(1)在反应中参加反应的是乙醇气体,由于乙醇具有挥发性,且乙醇的沸点大约是78℃,所以甲装置常常浸在70~80 ℃的水浴中目的是使生成乙醇蒸气的速率加快且较均匀。
(2)由于生成物乙醛以及乙醇都是与水易溶的,因此丁装置中导管直接插入到溶液中容易引起倒吸。
(3)连接戊装置的目的是防止倒吸的,因此要短口进,长口出,即乙接b,a接丙。

练习册系列答案
 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案
相关题目
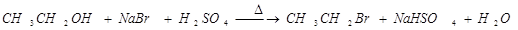 ,
,
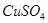 变蓝的原因是________________________。
变蓝的原因是________________________。