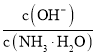题目内容
【题目】已知有:H、C、O、S、Cl、Fe六种元素,则回答下列有关其性质:
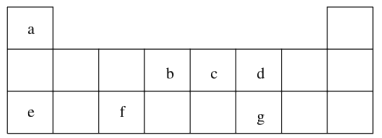
![]() 原子价电子的排布为 ______ ;Cl位于周期表中位置: ______ ;C原子核外有 ______ 个能级。
原子价电子的排布为 ______ ;Cl位于周期表中位置: ______ ;C原子核外有 ______ 个能级。
![]() 用“
用“![]() ”或“
”或“![]() ”填空:还原性:HCl ______
”填空:还原性:HCl ______ ![]() ,半径:C ______ O
,半径:C ______ O
![]() 在NaOH溶液中用Fe作阳极,通过电解制取
在NaOH溶液中用Fe作阳极,通过电解制取![]() 的电极反应式为: ______
的电极反应式为: ______
![]() 已知1molS完全燃烧生成
已知1molS完全燃烧生成![]() 放出akJ热量;又知
放出akJ热量;又知![]() ;
;![]() ;则请写出1mol固体S生成气体
;则请写出1mol固体S生成气体![]() 的热化学方程式为 ______
的热化学方程式为 ______
【答案】![]() 第三周期第VIIA族 3
第三周期第VIIA族 3 ![]()
![]()
![]()
![]()
【解析】
![]() 为26号元素,位于第四周期第VIII族,价电子排布为:
为26号元素,位于第四周期第VIII族,价电子排布为:![]() ,Cl处于第三周期第VIIA族,C原子序数为6,分别是1s、2s和2p。
,Cl处于第三周期第VIIA族,C原子序数为6,分别是1s、2s和2p。
![]() 与S处于同一周期,原子序数越大,非金属性越强,氢化物还原性越弱。
与S处于同一周期,原子序数越大,非金属性越强,氢化物还原性越弱。
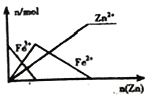
![]() 用电化学法制取
用电化学法制取![]() ,由图可知Fe为阳极失去电子,由此得出阳极反应式。
,由图可知Fe为阳极失去电子,由此得出阳极反应式。
![]() 依据已知信息书写两个热化学方程式如下:
依据已知信息书写两个热化学方程式如下:![]() ,
,![]() ;则利用盖斯定律,将
;则利用盖斯定律,将![]() 可得1mol固体S生成气体
可得1mol固体S生成气体![]() 的热化学方程式。
的热化学方程式。
![]() 为26号元素,位于第四周期第VIII族,价电子排布为:
为26号元素,位于第四周期第VIII族,价电子排布为:![]() ,Cl处于第三周期第VIIA族,C原子序数为6,有3个能级,分别是1s、2s和2p。答案为:
,Cl处于第三周期第VIIA族,C原子序数为6,有3个能级,分别是1s、2s和2p。答案为:![]() ;第三周期第VIIA族;3;
;第三周期第VIIA族;3;
![]() 与S处于同一周期,原子序数越大,非金属性越强,氢化物还原性越弱,故还原性
与S处于同一周期,原子序数越大,非金属性越强,氢化物还原性越弱,故还原性![]() ,原子序数
,原子序数![]() ,故半径
,故半径![]() 。答案为:
。答案为:![]() ;
;![]() ;
;
![]() 用电化学法制取
用电化学法制取![]() ,由图可知Fe为阳极失去电子,则阳极反应为
,由图可知Fe为阳极失去电子,则阳极反应为![]() 。答案为:
。答案为:![]() ;
;
![]() 已知
已知![]() ,
,![]() ;则利用盖斯定律,将
;则利用盖斯定律,将![]() 可得
可得![]() 。答案为:
。答案为:![]() 。
。

【题目】某温度下,0.200 molL-1的HA溶液与0.200 molL-1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是
微粒 | X | Y | Na+ | A- |
浓度/(mol·L-1) | 8.00 | 2.50 | 0.100 | 9.92 |
A. 0.1mol·L-1HA溶液的pH=1 B. 该温度下Kw=1.0![]() 10-14
10-14
C. 微粒X表示OH-,Y表示H+ D. 混合溶液中:n(A-)+n(X)=n(Na+)