题目内容
【题目】如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是
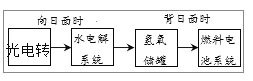
A.该能量转化系统中的水也是可以循环的
B.燃料电池放电时的负极电极反应式:2H2+4OH--4e-=4H2O
C.燃料电池放电时的正极电极反应式:2H2O+O2+4e-=4OH-
D.燃料电池系统产生的能量实际上来自于水
【答案】D
【解析】
根据空间站能量转化系统局部示意图可知,向日面时发生水的分解反应,背日面时发生氢气和氧气生成水的电池反应,再结合系统中KOH溶液的变化来分析解答。
A、由转化系统可知,水分解后还可再生成,则水是循环使用的,选项A正确;
B、该燃料电池放电时的负极发生氧化反应,在碱性环境下,2H2+4OH--4e-=4H2O,选项B正确;
C、该燃料电池放电时的正极发生还原反应,在碱性环境下,2H2O+O2+4e-=4OH-,选项C正确;
D、燃料电池系统产生的能量来源于化学反应产生的化学能,属于化学能转变为电能,不是来源于水,选项D不正确;
答案选D。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案【题目】实验室制备硝基苯的反应原理和实验装置如下:
![]() +HO—NO2
+HO—NO2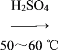
![]() +H2O ΔH<0
+H2O ΔH<0
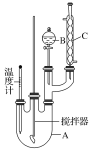
存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯,有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
实验步骤如下:
取100 mL烧杯,用20 mL浓硫酸与18 mL浓硝酸配制混合液,将混合酸小心加入B中,把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混,边滴边搅拌,混合均匀,在50~60 ℃下发生反应,直至反应结束。将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5% NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210 ℃馏分,得到纯硝基苯18g。回答下列问题:
(1)装置A的名称是______,装置C的作用是____________。
(2)配制混合液时,_____(填“能”或“不能”)将浓硝酸加入到浓硫酸中,说明理由:________________。
(3)为了使反应在50~60℃下进行,常用的方法是_______。
(4)在洗涤操作中,第二次水洗的作用是________________。
(5)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用直形冷凝管的原因是__________。
(6)本实验所得到的硝基苯产率是_____(结果保留2位有效数字,已知硝酸过量)。