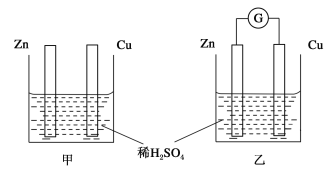
题目内容
【题目】有A、B、C、D四种元素,已知A元素原子的第一层和第三层电子数相同;B元素原子的第二层比第一层电子数多5个;C元素的+3价阳离子和氖原子具有相同的电子数;D元素的原子核外有4个电子层, 第一层与第二层电子数之和等于第三层与第四层电子数之和。写出:
(1)元素符号:A ,B ,C ,D 。
(2)A、D的原子结构示意图 、 ,C的离子结构示意图
化合物AB2的电子式____________ 化学键类型为__________
【答案】(1)Mg;F;Al;Ca;(2)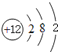 ,
,![]() ,
,![]() (3)
(3)![]() ,离子键
,离子键
【解析】试题分析:(1)A、B、C、D四种元素,A元素原子的第一层和第三层电子数相同,第三层电子数为2,故A为Mg;B元素原子的第二层比第一层电子数多5个,第二层电子数为7,故B为F元素;C元素的+3价阳离子和氖原子具有相同的电子数,则C为Al;D元素的原子核外有4个电子层,第一层与第二层电子数之和等于第三层与第四层电子数之和,则第三层、第四层电子数之和为10,说明原子核外各层电子数分别为2、8、8、2,故D为Ca元素,故答案为:Mg;F;Al;Ca;
(2)A为Mg,原子结构示意图为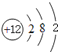 ,D为Ca,原子结构示意图为
,D为Ca,原子结构示意图为![]() ,C的离子为Al3+,离子结构示意图为
,C的离子为Al3+,离子结构示意图为![]() ;
;
(3)A与B所形成的化合物为MgF2,电子式为![]() ,含有离子键。
,含有离子键。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目