题目内容
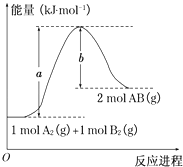
【题目】在容积不变的密闭容器中存在如下反应:2A(g)+B(g)![]() 3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
3C(g)+D(s)△H<0,在其他条件不变时,改变某一条件对上述反应的影响,下列分析不正确的是
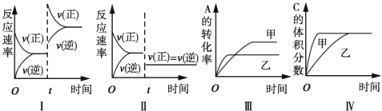
A. 图I表示增加反应物浓度对该平衡的影响
B. 图II表示减小压强对该平衡的影响
C. 图Ⅲ表示温度对该平衡的影响,温度:乙>甲
D. 图IV表示催化剂对该平衡的影响,催化效率:甲>乙
【答案】A
【解析】
A、增大反应物的浓度,正逆反应速率均增大,但是在增大的瞬间,逆反应速率不变,所以逆反应速率在t时刻不变,不会离开原平衡点,故A错误;
B、反应前后气体体积不变,压强变化不影响平衡移动,但减小压强反应速率减慢,故B正确;
C、先拐先平数值大,说明乙的温度高于甲,升温平衡逆向移动,A的转化率降低,故C正确;
D、催化剂不影响平衡移动,可以缩短反应达到平衡所用时间,故D正确;
故答案选A。

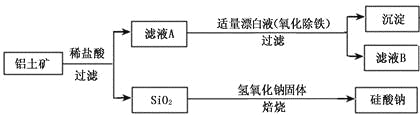
【题目】如图是从铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:

(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH,赤泥的主要成分为_______(写出化学式)。
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为______(写出化学式)。 实验室过滤需用到的玻璃仪器有烧杯、__________、玻璃棒。
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_______。
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00 mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如下表所示。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
实验序号 | I | II | III |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为_____。
②所用NaOH溶液的浓度为___mol/L。