题目内容
【题目】如图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是
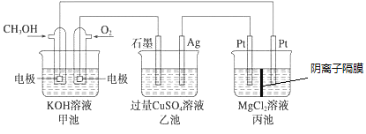
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使溶液恢复原浓度
D. 甲池中消耗4.48L(标准状况下)O2,此时丙池中理论上最多产生23.2 g固体
【答案】D
【解析】
A.甲池是燃料电池,是化学能转化为电能的装置,乙,丙是电解池是将电能转化为化学能的装置。故A错误;
B.甲池通入CH3OH的电极为负极,甲醇失电子发生氧化反应,在碱性电解质下的电极反应为:CH3OH-6e-+2H2O+8OH-=CO32-+8H2O,故B错误。
C.电解池乙池中,电解后生成硫酸,铜与氧气,要想复原,需要加入氧化铜,故C错误;
D.甲池中根据电极反应:O2+2H2O+4e-=4OH-,消耗4.48L(标况下为0.2mol)O2则转移0.8mol电子,根据丙装置中,阴极的电极反应为:2H2O+2e-+Mg2+=Mg(OH)2,由电子守恒可得理论上最多生成氢氧化镁0.4mol×58g/mol=23.2g,故D正确;
答案选D。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】标号为①~⑩的元素,在元素周期表中的位置如下:
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
试回答下列问题:
(1)(填写元素符号)① _____③______⑤_____ ⑦_____
(2)①和④号元素形成的化合物的化学式________,用电子式表示其形成过程为__________。
(3)⑦和⑧号元素的最高价氧化物的水化物的碱性是: ______﹥_________ (填化学式)。⑨和⑩号元素的最高价氧化物的水化物的酸性是: ______ ﹥_________ (填化学式)。
(4)①、⑤、⑦号元素形成的一种化合物的电子式是________,在该化合物中既含有________键,又含有________键。
【题目】某同学用某种粗盐进行提纯实验,步骤见下图。

请回答:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法_________________________________。步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止_______________,当蒸发皿中有较多量固体出现时,应___________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | ________ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入____,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | ________ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,_______________ | ________ | 猜想Ⅲ成立 |
【题目】下表是元素周期表的一部分,请回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为__________。
(2)⑨在元素周期表中的位置是_______________________________。
(3)用电子式表示④与⑦的原子形成化合物的过程:_________________________________。
(4)可以用来验证④⑤两种元素金属性强弱的实验是__________(填字母代号)。
a.将在空气中放置已久的这两种元素的块状单质分别放入水中
b.将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
c.将形状、大小相同的这两种元素的单质分别和温度相同的热水作用,并滴入酚酞
d.比较这两种元素的氢化物的稳定性
(5)⑥⑦两种元素的简单阴离子还原性较强的是________(填离子符号);用一个置换反应证实这一结论__________________________(填化学方程式)。





