题目内容
某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置图如下:
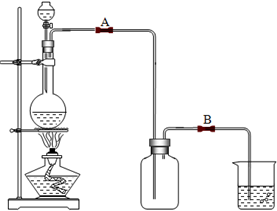
(1)写出该反应的化学方程式: ;
(2)上述反应中,还原剂是 ,若有1mol氧化剂参加反应,转移的电子的物质的量是 mol.
(3)实验开始前,某学生对装置进行了气密性检查.方法是:连接好装置后,用弹簧夹夹住处(填“A”或“B”)橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察,当观察到分液漏斗中 时,表明该装置不漏气.
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中最好的是(填序号) .
A.氢氧化钠溶液 B.碳酸钠浓溶液 C.浓硫酸.

(1)写出该反应的化学方程式:
(2)上述反应中,还原剂是
(3)实验开始前,某学生对装置进行了气密性检查.方法是:连接好装置后,用弹簧夹夹住处(填“A”或“B”)橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察,当观察到分液漏斗中
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中最好的是(填序号)
A.氢氧化钠溶液 B.碳酸钠浓溶液 C.浓硫酸.
考点:氯气的实验室制法
专题:卤族元素
分析:(1)根据浓盐酸和二氧化锰的性质判断生成物,从而写出反应方程式;
(2)根据浓盐酸和二氧化锰的性质判断,Cl元素化合价由-1价升高到0价,被氧化,HCl为还原剂,结合化合价的变化以及反应的方程式可计算转移电子的数目;
(3)设法使装置内外形成气压差是气密性检查的常用手段,通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(4)根据氯气的化学性质判断;
(2)根据浓盐酸和二氧化锰的性质判断,Cl元素化合价由-1价升高到0价,被氧化,HCl为还原剂,结合化合价的变化以及反应的方程式可计算转移电子的数目;
(3)设法使装置内外形成气压差是气密性检查的常用手段,通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(4)根据氯气的化学性质判断;
解答:
解:(1)浓盐酸有还原性,二氧化锰有氧化性,浓盐酸和二氧化锰能发生氧化还原反应生成氯化锰、氯气和水,其反应为MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O;
故答案为:4HCl(浓)+MnO2
MnCl2+2H2O+Cl2↑;
(2)该反应中化合价的变化为:MnO2→MnCl2 ,锰元素由+4价→+2价,MnO2为氧化剂,1mol二氧化锰得2mol电子;HCl→Cl↑,氯元素由-1价→0价,HCl为还原剂,1molHCl失去1mol电子,若有1mol氧化剂MnO2参加反应,转移的电子的物质的量是2mol,
故答案为:HCl(盐酸或浓盐酸);2;
(3)装置气密性的检查:连接好装置后,用弹簧夹夹住B构成封闭体系,向分液漏斗中加水并打开活塞,漏斗中的液面高度不变,说明气密性良好,
故答案为:B;液面(水面)不下降;
(4)氯气和水反应生成盐酸和次氯酸,盐酸和次氯酸具有酸性,盐酸是强酸,能和碱或弱酸盐反应.碳酸钠的浓溶液可以吸收氯气,稀溶液不可以完全吸收;氯气不与浓硫酸反应,则不能用来吸收残余氯气;
故答案为:A.
| ||
故答案为:4HCl(浓)+MnO2
| ||
(2)该反应中化合价的变化为:MnO2→MnCl2 ,锰元素由+4价→+2价,MnO2为氧化剂,1mol二氧化锰得2mol电子;HCl→Cl↑,氯元素由-1价→0价,HCl为还原剂,1molHCl失去1mol电子,若有1mol氧化剂MnO2参加反应,转移的电子的物质的量是2mol,
故答案为:HCl(盐酸或浓盐酸);2;
(3)装置气密性的检查:连接好装置后,用弹簧夹夹住B构成封闭体系,向分液漏斗中加水并打开活塞,漏斗中的液面高度不变,说明气密性良好,
故答案为:B;液面(水面)不下降;
(4)氯气和水反应生成盐酸和次氯酸,盐酸和次氯酸具有酸性,盐酸是强酸,能和碱或弱酸盐反应.碳酸钠的浓溶液可以吸收氯气,稀溶液不可以完全吸收;氯气不与浓硫酸反应,则不能用来吸收残余氯气;
故答案为:A.
点评:本题考查了实验室制备氯气的方法和原理分析,氯气性质的分析应用,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各组物质,不用任何化学试剂,只需用相互反应的方法就能够鉴别的是( )
| A、盐酸、Na2CO3溶液、NaCl溶液、AgNO3溶液 |
| B、Cl2、HCl、HBr |
| C、BaCl2溶液、NaOH溶液、AgNO3溶液、NaCl溶液 |
| D、NaCl溶液、NaBr溶液、NaI溶液 |
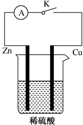 某同学为了探究原电池产生电流的过程,设计了如图所示实验.
某同学为了探究原电池产生电流的过程,设计了如图所示实验.
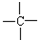 和
和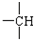 等结合成的.如果某烷分子中同时存在这4种基团,所含碳原子数最小,这种烷烃分子应含
等结合成的.如果某烷分子中同时存在这4种基团,所含碳原子数最小,这种烷烃分子应含